
族 周期 | ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
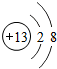 ,G元素的最高價氧化物化學式CO2,H的氫化物的化學式NH3
,G元素的最高價氧化物化學式CO2,H的氫化物的化學式NH3 ;
;
分析 由元素在周期表中的位置可知A、B、C、D、E、F、G、H分別為Ca、Na、Al、F、Cl、K、C、N,
(1)C為Al,對應的離子核外有2個電子層,最外層電子數為8,G為C元素,對應的最高價氧化物為二氧化碳,H為N元素,對應氫化物為氨氣;
(2)H為N元素,對應單質為氮氣,存在N≡N鍵;
(3)(a)根據元素核外電子層數越多、半徑越大,同周期元素從左到右原子半徑逐漸減小判斷;
(b)元素的金屬性越強,單質的還原性越最強;
(c)元素的非金屬性越強,對應最高價氧化物對應水化物酸性越強;
(d)元素的金屬性越強,對應的最高價氧化物對應水化物堿性越強;
(4)AE2為CaCl2,為離子化合物;
(5)B與C的最高價氧化物對應水化物的分別為氫氧化鈉和氫氧化鋁,氫氧化鋁為兩性氫氧化物.
解答 解:由元素在周期表中的位置可知A、B、C、D、E、F、G、H分別為Ca、Na、Al、F、Cl、K、C、N,
(1)C為Al,對應的離子核外有2個電子層,最外層電子數為8,離子的結構示意圖為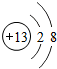 ,
,
G為C元素,對應的最高價氧化物為二氧化碳,化學式為CO2,H為N元素,對應氫化物為氨氣,化學式為NH3,
故答案為: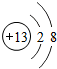 ;CO2;NH3;
;CO2;NH3;
(2)H為N元素,對應單質為氮氣,存在N≡N鍵,電子式為 ,故答案為:
,故答案為: ;
;
(3)(a)元素核外電子層數越多、半徑越大,同周期元素從左到右原子半徑逐漸減小,可知原子半徑最大的為K,故答案為:K;
(b)由元素所在周期表中的位置可知K元素的金屬性最強,元素的金屬性越強,單質的還原性越最強,故答案為:K;
(c)題中涉及元素中Cl的非金屬性最強,對應最高價氧化物對應水化物酸性最強,為HClO4,故答案為:HClO4;
(d)K元素的金屬性最強,對應的最高價氧化物對應水化物堿性越強,為KOH,故答案為:KOH;
(4)氯化鈣為離子化合物,用電子式表示下列物質的形成過程為 ,
,
故答案為: ;
;
(5)B與C的最高價氧化物對應水化物的分別為氫氧化鈉和氫氧化鋁,氫氧化鋁為兩性氫氧化物,反應離子方程式為:Al(OH)3+OH-═AlO2-+2H2O,
故答案為:Al(OH)3+OH-═AlO2-+2H2O.
點評 本題考查位置、結構與性質的關系,為高頻考點,把握元素的位置、元素周期律及結構與性質的關系為解答的關鍵,側重分析與應用能力的考查,題目難度不大.


 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案科目:高中化學 來源: 題型:解答題
 ;1124Na.
;1124Na.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH3 平面三角形 sp3雜化 | B. | CCl4 正四面體 sp3雜化 | ||
| C. | H2O V形 sp2雜化 | D. | CO32- 三角錐形 sp3雜化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
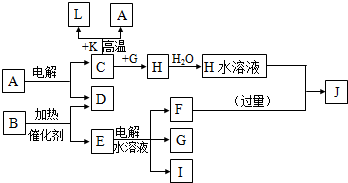
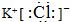 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ①③⑥ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com