
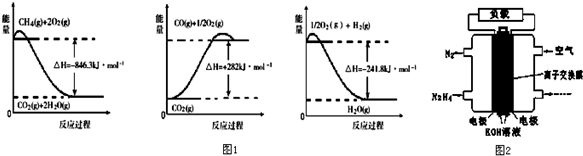
分析 (1)依據圖象分析各個反應過程中能量變化情況,寫出熱化學方程式,依據蓋斯定律計算CH4(g)與H2O(g)反應生成CO(g)和H2(g)的反應熱,據此寫出熱化學方程式;
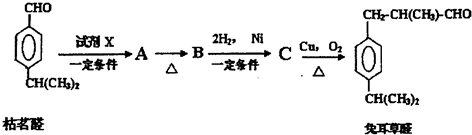
(2)該燃料電池中,負極上燃料失電子發生氧化反應,左側為負極,電極反應式為:N2H4+4OH--4e-=N2↑+4H2O,正極上氧氣得電子發生還原反應,右側為正極,電極反應式為:O2+2H2O+4e-=4OH-,電池總反應為:N2H4+O2=N2↑+2H2O,結合離子的移動方向、電流的方向,電子守恒規律分析解答①②③;
④用惰性電極電極硫酸銅,陽極上水電離產生的氫氧根離子失去電子發生氧化反應,促進水的電離;
串聯電路中電解池、原電池中各個電極上通過的電量相等,依據消耗32mg液態肼時,計算各個電極上轉移的電子的數目,依據電解池陽極發生反應4OH--4e-=2H2O+O2↑,計算消耗的氫氧根離子,進而計算生成的氫離子的物質的量和物質的量濃度,依據pH計算公式求溶液pH值.
解答 解:(1)由圖象分析反應過程都是能量降低的過程,說明反應是放熱反應;反應的熱化學方程式分別為:
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282KJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
由蓋斯定律①-③×3-②得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1,
故答案為:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1;
(2)①該燃料電池中,負極上燃料失電子發生氧化反應,左側為負極,右側為正極,電流從正極出發經過負載流向負極,
故答案為:右;左;
②負極上燃料失電子發生氧化反應,左側為負極,電極反應式為:N2H4+4OH--4e-=N2↑+4H2O;
故答案為:N2H4+4OH--4e-=N2↑+4H2O;
③該原電池中,正極上生成氫氧根離子,所以離子交換膜要選取陰離子交換膜,
故答案為:陰離子;
④惰性電極電極硫酸銅溶液時,水中氫氧根離子在陽極上放電,不斷消耗,促進了水的電離,使水的電離平衡向右移動;
依據N2H4+4OH--4e-=N2↑+4H2O可知消耗32g肼轉移4mol電子,所以消耗32mg液態肼時,轉移電子數為0.004mol,電極池中4OH--4e-=2H2O+O2↑,轉移0.004mol電子,消耗0.004molOH-,同時生成0.004molH+,所以C(H+)=$\frac{0.004mol}{0.4L}$=0.01mol,溶液的pH=-lg[H+]=2;
故答案為:右;2.
點評 本題考查了熱化學方程式的書寫、燃料電池、電解池工作原理,熟悉蓋斯定律計算反應熱的方法和燃料電池、電解池工作原理是解題關鍵,注意有關電化學計算中電子守恒的應用.


科目:高中化學 來源: 題型:解答題
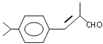 ;檢驗B中的官能團時,需先加入的試劑是新制氫氧化銅懸濁液;酸化后,再加入的試劑是溴水或高錳酸鉀溶液.
;檢驗B中的官能團時,需先加入的試劑是新制氫氧化銅懸濁液;酸化后,再加入的試劑是溴水或高錳酸鉀溶液. .
.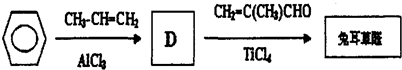
 .D→兔耳草醛的反應類型是加成反應.
.D→兔耳草醛的反應類型是加成反應. 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸鎂晶體分解反應是放熱反應 | B. | 氯化鎂水解是熵增反應 | ||
| C. | 硫酸鎂晶體分解反應是熵減反應 | D. | 氯化鎂分解放熱比硫酸鎂少 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaCl、NaClO | B. | NaCl、NaClO3 | C. | NaClO、NaClO3 | D. | NaClO3、NaClO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在蒸餾水中滴加濃H2SO4,KW不變 | |
| B. | 25℃時,在 c(H+)=$\sqrt{{K}_{W}}$的溶液中,大量存在Na+、S2-、NO3-、CO32-等離子 | |
| C. | 常溫,0.1mol•L-1的NaHSO3溶液的pH=6,則c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) | |
| D. | NaCl溶液和CH3COONH4溶液均顯中性,兩溶液中水的電離程度相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol•L-1NaClO溶液中含有的ClO-數目為NA | |
| B. | 常溫常壓下,11.2 L Cl2含氯原子數為NA | |
| C. | 一定條件下,將1 mol N2和3 mol H2混合,充分反應后轉移的電子數為6NA | |
| D. | 6.4 g由S2、S4、S8組成的混合物含硫原子數為0.2 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 一定條件下,固定容積的密閉容器中,CO和H2反應生成甲醇:CO(g)+2H2(g)?CH3OH(g).如圖是該反應在不同溫度下CO的轉化率隨時間變化的曲線.下列判斷正確的是( )
一定條件下,固定容積的密閉容器中,CO和H2反應生成甲醇:CO(g)+2H2(g)?CH3OH(g).如圖是該反應在不同溫度下CO的轉化率隨時間變化的曲線.下列判斷正確的是( )| A. | T1>T2,該反應的△H>0 | |
| B. | 加入催化劑可以提高CO的轉化率 | |
| C. | T1時的平衡常數K1>T2時的平衡常數K2 | |
| D. | CO(g)+2H2(g)?CH3OH(1)的△H值將變大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 電滲析法是一種利用A、B離子交換膜進行海水淡化的方法,其原理如圖所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等離子,電極為惰性電極.下列敘述中正確的是( )
電滲析法是一種利用A、B離子交換膜進行海水淡化的方法,其原理如圖所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等離子,電極為惰性電極.下列敘述中正確的是( )| A. | 是原電池裝置,把化學能轉化為電能 | |
| B. | 是電解裝置,只發生物理變化 | |
| C. | 左右池中得到淡水 | |
| D. | A膜是陰離子交換膜,B膜是陽離子交換膜 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com