
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A、該反應的化學方程式是CO(g)+H2O(g)═CO2(g)+H2(g) | ||||
| B、上述反應的正反應是放熱反應 | ||||
| C、若在一定體積的密閉容器中通入CO2和H2各1mol,5 min后溫度升高到830℃,此時測得CO2為0.4 mol時,該反應達到平衡狀態 | ||||
D、若平衡濃度符合下列關系式:
|
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 0.4×0.4 |
| 0.6×0.6 |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 3 |
| 5 |
| c(CO2) |
| 3c(CO) |
| c(H2O) |
| 5c(H2) |


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
(2012?松江區一模)已知某化學反應的平衡常數表達式為K=
|
查看答案和解析>>
科目:高中化學 來源: 題型:
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A、上述反應的正反應是吸熱反應 | ||||
B、該反應的化學方程式是:CO2(g)+H2(g)
| ||||
C、某溫度下,如果平衡濃度符合下列關系式:
| ||||
| D、如果在一定體積的密閉容器中加入CO2和H2各1mol,5min后溫度升高到830℃,測得CO為0.4 mol時,該反應為平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:
已知某化學反應的平衡常數表達式為K=![]()
![]() ,在不同的溫度下該反應的平衡常數值分別為:
,在不同的溫度下該反應的平衡常數值分別為:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有關敘述不正確的是( )
A.該反應的化學方程式是:CO(g)+![]() (g)
(g)![]()
![]()
B.上述反應的正反應是放熱反應.
C.如果在一定體積的密閉容器中加入![]() 和
和![]() 各1 mol,5 min后溫度升高到
各1 mol,5 min后溫度升高到
830℃,此時測得![]() 為0.4 mol時,該反應為平衡狀態。
為0.4 mol時,該反應為平衡狀態。
D.某溫度下,如果平衡濃度符合下列關系式:![]() ,判斷此時的溫度是1000℃.
,判斷此時的溫度是1000℃.
查看答案和解析>>
科目:高中化學 來源:2011-2012學年上海市松江區高三上學期期末(1月)考試化學試卷(解析版) 題型:選擇題
已知某化學反應的平衡常數表達式為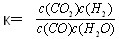 ,在不同的溫度下該反應的平衡常數值分別為:
,在不同的溫度下該反應的平衡常數值分別為:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
1.67 |
1.11 |
1.00 |
0.60 |
0.38 |
有關敘述錯誤的是
A.該反應的化學方程式是:CO(g)+H2O(g) 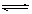 CO2(g)+H2(g)
CO2(g)+H2(g)
B.該反應的正反應是放熱反應
C.如果在一定體積的密閉容器中加入CO和H2O各1 mol,再把溫度升高到830 ℃,此時測得CO2為0.4 mol時,這時可逆反應處于平衡狀態
D.若平衡濃度關系符合 =
=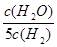 ,可判斷此時溫度是1000 ℃
,可判斷此時溫度是1000 ℃
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com