
| A. | 若反應過程轉移0.2mol電子,則生成0.1mol羰基硫 | |
| B. | CO和H2S的反應中,H2S作還原劑 | |
| C. | 羰基硫的化學式為COS,是一種共價化合物 | |
| D. | 1mol羰基硫完全燃燒,消耗1.5mol氧氣 |
分析 常溫下,在恒容密閉容器中,將CO和H2S按1:1混合加熱可得到羰基硫和氫氣,且反應前后壓強不變,說明反應是個氣體的物質的量不變的反應,根據質量守恒可知發生的化學方程式為CO+H2S=COS+H2,此反應轉移2mol電子,H2S為氧化劑,被還原為氫氣,CO為還原劑,故氧化為COS,據此分析.
解答 解:常溫下,在恒容密閉容器中,將CO和H2S按1:1混合加熱可得到羰基硫和氫氣,且反應前后壓強不變,說明反應是個氣體的物質的量不變的反應,根據質量守恒可知發生的發生的化學方程式為CO+H2S=COS+H2.
A.有反應方程式可知,反應轉移2mol電子生成1molCOS,故當反應過程轉移0.2mol電子,同時生成0.1mol羰基硫,故A正確;
B.CO和H2S的反應中,H2S被還原為氫氣作氧化劑,故B錯誤;
C.羰基硫的化學式為COS,全部由非金屬元素構成,故為共價化合物,故C正確;
D.COS的燃燒反應為:2COS+3O2$\frac{\underline{\;點燃\;}}{\;}$2CO2+2SO2,可知1mol羰基硫完全燃燒,消耗1.5mol氧氣,故D正確;
故選B.
點評 本題考查了根據題干信息寫出化學方程式并對化學方程式轉移電子數、氧化劑還原劑進行分析,難度不大,應注意的是在恒溫恒容的容器中,壓強不變則說明氣體的物質的量不變.


科目:高中化學 來源: 題型:解答題
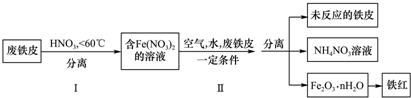
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 通過電解飽和食鹽水可制得單質Na | |
| B. | 工業上常用H2還原MgO制得單質Mg | |
| C. | 通過加熱分解HgO可制得單質Hg | |
| D. | 用鋁熱法還原MnO2和Fe2O3,制得金屬各1mol,消耗鋁較少的是MnO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ag2S | B. | HgS | C. | HgCl2 | D. | AgCl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
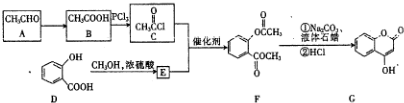
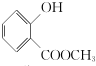 ,G中所含官能團的名稱為酯基、碳碳雙鍵、羥基;
,G中所含官能團的名稱為酯基、碳碳雙鍵、羥基;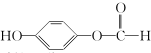 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
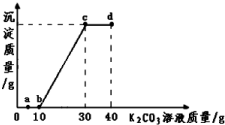
| A. | 向a點對應的溶液中滴加無色酚酞試液,溶液為無色 | |
| B. | 該溫度下,K2CO3的溶解度為100g | |
| C. | 由圖象可得,10g該溶液中氯化鈣的質量約為8g | |
| D. | b、c、d三點對應的溶液中分別含有兩種溶質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鐵及其化合物在生產、生活中有廣泛應用,如高鐵酸鉀(K2FeO4)具有極強的氧化性,是一種優良的水處理劑;又知高爐煉鐵過程中發生的主要反應為:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是該反應在不同溫度下的平衡常數:
鐵及其化合物在生產、生活中有廣泛應用,如高鐵酸鉀(K2FeO4)具有極強的氧化性,是一種優良的水處理劑;又知高爐煉鐵過程中發生的主要反應為:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)+Q kJ,下表中是該反應在不同溫度下的平衡常數:| 溫度/℃ | 1000 | 1115 | 1300 |
| 平衡常數 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com