
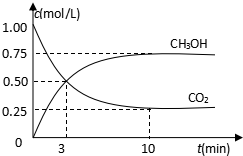
 隨著人類對溫室效應和資源短缺等問題的重視,如何降低大氣中CO2的含量及有效地開發(fā)利用CO2,引起了各國的普遍重視.目前工業(yè)上有一種方法是用CO2來生產燃料甲醇.為探究反應原理,現進行如下實驗,在485℃時,在體積為1L的密閉容器中,充入1ol CO2和3mol H2,一定條件下發(fā)生反應合成甲醇:
隨著人類對溫室效應和資源短缺等問題的重視,如何降低大氣中CO2的含量及有效地開發(fā)利用CO2,引起了各國的普遍重視.目前工業(yè)上有一種方法是用CO2來生產燃料甲醇.為探究反應原理,現進行如下實驗,在485℃時,在體積為1L的密閉容器中,充入1ol CO2和3mol H2,一定條件下發(fā)生反應合成甲醇:分析 (1)依據原子守恒確定物質為水,該制備在485℃時發(fā)生反應合成甲醇生成的水為氣體;
(2)①圖象分析計算甲醇的反應速率,根據反應速率之比等于化學方程式計量數之比計算得到氫氣表示的反應速率;
②平衡常數=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$;
③結合化學三行計算列式計算平衡狀態(tài)下各物質的平衡濃度,通過平衡常數的概念平衡常數=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$,計算得到平衡常數;
(3)根據化學平衡狀態(tài)的特征解答,當反應達到平衡狀態(tài)時,正逆反應速率相等,各物質的濃度、百分含量不變,以及由此衍生的一些量也不發(fā)生變化,解題時要注意,選擇判斷的物理量,隨著反應的進行發(fā)生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態(tài);
(4)使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$應采取措施,使平衡向正反應移動,注意不能增大二氧化碳或降低甲醇的量;
解答 解:(1)CO2(g)+3H2(g)?CH3OH(g)+?,反應前后原子守恒,則未知物質含有2個H原子和1個氧原子,物質為水,在485℃時,在體積為1L的密閉容器中,充入1ol CO2和3mol H2,一定條件下發(fā)生反應合成甲醇和氣體水,則熱化學方程式為:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,
故答案為:H2O(g);
(2)①圖象可知反應達到平衡狀態(tài)時甲醇生成濃度=0.75mol/L,所以甲醇表示的反應速率v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/L•min,反應速率之比等于化學方程式計量數之比,v(H2)=3v(CH3OH)=3×0.075mol/L•min=0.225mol/L•min,
故答案為:0.225;
②依據化學方程式CO2(g)+3H2(g)?CH3OH(g)+H2O(g),反應的平衡常數K=$\frac{[C{H}_{3}OH][{H}_{2}O]}{[C{O}_{2}][{H}_{2}]^{3}}$
故答案為:$\frac{[C{H}_{3}OH][{H}_{2}O]}{[C{O}_{2}][{H}_{2}]^{3}}$;
③圖象可知,二氧化碳起始量濃度為1.00mol/L,平衡狀態(tài)下二氧化碳濃度為0.25mol/L,甲醇平衡濃度為0.75mol/L,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
變化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
平衡常數K=$\frac{[C{H}_{3}OH][{H}_{2}O]}{[C{O}_{2}][{H}_{2}]^{3}}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$L2/mol2=5.33L2/mol2,
故答案為:5.33L2/mol2;
(3)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,反應是氣體體積減小的放熱反應,依據化學平衡移動原理分析選項,變量不變說明反應達到平衡狀態(tài),
A.反應前后氣體物質的量變化,當容器中壓強不變說明反應達到平衡狀態(tài),故A正確;
B.混合氣體中c(CO2)不變的狀態(tài)是平衡標志,故B正確;
C.反應速率之比等于化學方程式計量數之比,當3V逆(H2O)=V正 (H2)時說明水的正逆反應速率相同,反應達到平衡狀態(tài),但V逆(H2O)=3V正 (H2)不能說明反應達到平衡狀態(tài),故C錯誤;
D.反應前后氣體質量和體積不變,反應過程中和平衡狀態(tài)下混合氣體的密度始終保持不變,說明反應達到平衡狀態(tài),故D錯誤;
E.速率之比等于化學方程式計算之比為正反應的速率之比,用CO2、H2、CH3OH的物質的量濃度變化表示的反應速率的比為1:3:1的狀態(tài),不能說明反應達到平衡狀態(tài),故E錯誤;
F.反應前后氣體質量不變,氣體物質的量變化,當混合氣體的平均相對分子質量不再改變,說明反應達到平衡狀態(tài),故F正確;
故答案為:A、B、F;
(4)使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$應采取措施,使平衡向正反應移動,注意不能增大二氧化碳或降低甲醇的量,
A、該反應正反應是放熱反應,升高溫度平衡向逆反應移動,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$減小,故A錯誤,
B、充入He(g),使體系壓強增大,容器的容積不變,反應混合物的濃度不變,平衡不移動,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$不變,故B錯誤,
C、將H2O(g)從體系中分離,平衡向正反應移動,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故C正確,
D、再充入1mol CO2和3mol H2,等效為增大壓強,平衡向正反應移動,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故D正確;
故答案為:C、D.
點評 本題考查反應速率計算、化學平衡常數的計算,反應速率、平衡狀態(tài)影響因素、平衡狀態(tài)分析判斷,熱化學方程式書寫,難度中等,注意基礎知識的掌握.


科目:高中化學 來源: 題型:解答題
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 9.820g晶體中含有C2O42-的物質的量為0.006mol | |
| B. | 配制草酸合鐵酸鉀溶液玻璃儀器只需燒杯和玻璃棒 | |
| C. | 該晶體的化學式為K3Fe(C2O4)3•6H2O | |
| D. | 9.820g樣品中含K+的物質的量為0.06 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 用鉛蓄電池電解甲、乙電解池中的溶液.已知鉛蓄電池的總反應為:Pb+PbO2+2H2SO4═2PbSO4+2H2O,電解一段時間后向c極和d極附近分別滴加酚酞試劑,c極附近溶液變紅,下列說法正確的是( )
用鉛蓄電池電解甲、乙電解池中的溶液.已知鉛蓄電池的總反應為:Pb+PbO2+2H2SO4═2PbSO4+2H2O,電解一段時間后向c極和d極附近分別滴加酚酞試劑,c極附近溶液變紅,下列說法正確的是( )| A. | d極為陰極 | |
| B. | 放電時鉛蓄電池負極的電極反應式為:PbO2+4H++SO42-+4e-═PbSO4+2H2O | |
| C. | 若利用甲池精煉銅,b極應為粗銅 | |
| D. | 若電極材料均為石墨,當析出6.4g Cu時,兩池共產生氣體3.36L(標準狀況下) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 陳述Ⅰ | 陳述Ⅱ | |
| A | BaSO4難溶于水 | SO2氣體通入Ba(NO3)2溶液中沉淀 |
| B | 非金屬性:Cl>S | 酸性:HClO3>H2SO4 |
| C | 常溫下,NaHCO3的溶解度比Na2CO3小 | 向飽和Na2CO3溶液中通入CO2產生沉淀 |
| D | 常溫下,SO2與氫硫酸和NaOH溶液均可反應 | SO2是兩性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.
實驗室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com