

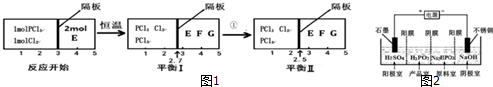
| A. | 含l mol H2SO4的濃溶液與足量NaOH反應,放出的熱量即為中和熱 | |
| B. | 途徑②增大O2濃度可提高SO2轉化率 | |
| C. | 途徑②中SO2和SO3均屬于酸性氧化物 | |
| D. | 若△Hl<△H2+△H3,則2H2O2(aq)=2H2O(1)+O2 (g)為放熱反應 |
分析 A、中和反應的定義:強酸與強堿的稀溶液混合生成1mol水放出的熱量為中和熱;
B、增大一種反應物的濃度可以增大另外一種反應物的轉化率;
C、二氧化硫與三氧化硫均屬于酸性氧化物;
D、焓值小于0為放熱反應,據此解答即可.
解答 解:A、中和反應的定義:強酸與強堿的稀溶液混合生成1mol水放出的熱量為中和熱,含l mol H2S04的濃溶液與足量NaOH反應生成2mol水,且濃溶液溶于水放熱,故A錯誤;
B、增大一種反應物的濃度可以增大另外一種反應物的轉化率,故途徑②增大02濃度可提高SO2轉化率正確,故B正確;
C、二氧化硫與三氧化硫均屬于酸性氧化物,故C正確;
D、焓值小于0為放熱反應,故D正確,
故選A.
點評 本題主要考查的是蓋斯定律的應用、化學反應吸熱與放熱的判斷、酸性氧化物和中和熱的概念,難度不大.


科目:高中化學 來源: 題型:解答題
| 弱酸 | 電離平衡常數(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol/L NaHCO3溶液與0.1 mol/L NaOH溶液等體積混合,所得溶液中:c(Na+)>c(C${{O}_{3}}^{2-}$)>c(HC${{O}_{3}}^{-}$)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液與10 mL 0.1 mol/L鹽酸混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室溫下,pH=2的鹽酸與pH=12的氨水等體積混合,所得溶液中:c(Cl-)>c(H+)>c(N${{H}_{4}}^{+}$)>c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液與0.1 mol/L NaOH溶液等體積混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol•L-1的Na2S溶液中,S2-的數目小于0.1 NA | |
| B. | 0.1 mol丙烷中含有的共價鍵數目為0.8 NA | |
| C. | 標準狀況下,11.2 L甲醇中含有的分子數目為0.5 NA | |
| D. | 0.1 mol氧化鈉和過氧化鈉的混合物中含有的離子總數為0.3 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 地球上CH4、CO2等氣體含量上升容易導致溫室效應加劇,進而引發災難性氣候 | |
| B. | 大量焚燒田間秸稈會產生霧霾,“霧”和“霾”為不同類別的分散系 | |
| C. | 太陽光分解水制氫氣、植物秸稈制沼氣、高粱制乙醇都涉及到生物質能的利用 | |
| D. | PbO2具有氧化性和導電性,可用作鉛蓄電池正極材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 | A | B | C | D | E |
| 性質或結構信息 | 室溫下單質呈氣態,原子最外層電子數與D相同 | D3B中陽離子與陰離子的電子層結構相同 | A和C可形成兩種常見的化合物甲和乙,乙具有弱酸性 | 單質質軟、銀白色固體、導電性強,在空氣中燃燒生成淡黃色固體 | E是一種氣態氧化物丙,丙相對于空氣的密度為3.0,溶于水可得只含單一溶質的弱酸性溶液,該溶液在放置過程中其酸性會增強 |
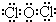 ;并說明丙的水溶液在放置過程中其酸性會增強的原因(用化學方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.
;并說明丙的水溶液在放置過程中其酸性會增強的原因(用化學方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉的化學性質很活潑,在自然界里不能以游離態存在 | |
| B. | 化學的特征就是認識分子 | |
| C. | 在化學反應中,參加反應的各物質的質量比等于其物質的量之比 | |
| D. | 俄國化學家門捷列夫提出原子學說,為近代化學的發展奠定了堅實的基礎 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
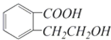 它可通過不同的反應分別得到下列物質:
它可通過不同的反應分別得到下列物質:
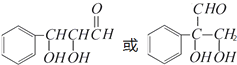 .(注:同一碳原子上連兩個或兩個以上羥基不穩定,故書寫時排除此類化合物.)
.(注:同一碳原子上連兩個或兩個以上羥基不穩定,故書寫時排除此類化合物.)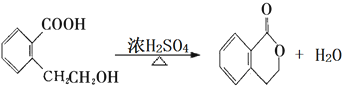 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com