
(1)寫出放電時負極上發生反應的化學方程式_____________________________。
(2)當蓄電池作為電源電解CuSO4溶液生成1.6 g Cu時,蓄電池內消耗H2SO4____________mol。
(3)給蓄電池充電時,若要使3.03 g PbSO4轉變為Pb和PbO2,需要____________ mol的電荷量。
解析:此題涉及蓄電池的電化學原理,電解CuSO4溶液的反應原理,電極反應和有關電池、電解反應的計算等知識點。考查學生的分析能力、計算能力以及思維的嚴密性和整體性。
解題的關鍵在于:①弄清蓄電池以及電解CuSO4溶液的反應原理;②把握住電池反應與電解反應中轉移的電子數相等這一恒等關系。
(1)蓄電池放電時,發生原電池反應
負極上的反應是Pb-2e-+SO![]() ====PbSO4
====PbSO4
(2)由電池反應有:2e-~2H2SO4的關系;又由電解反應2CuSO4+2H2O![]() 2Cu↓+2H2SO4+O2↑,有4e-~2Cu的關系。可得2H2SO4~Cu~2e-的關系,電解CuSO4溶液生成的Cu的物質的量為
2Cu↓+2H2SO4+O2↑,有4e-~2Cu的關系。可得2H2SO4~Cu~2e-的關系,電解CuSO4溶液生成的Cu的物質的量為![]() =0.025 mol。
=0.025 mol。
故蓄電池中消耗H2SO4的物質的量為2×0.025 mol=0.05 mol。
(3)蓄電池充電時發生電解反應![]() 有2e-~Pb~PbO2~2PbSO4的關系,即有e-~PbSO4的關系。
有2e-~Pb~PbO2~2PbSO4的關系,即有e-~PbSO4的關系。
3.03 g PbSO4的物質的量為3.03 g/303 g·mol-1=0.01 mol,轉變為Pb和PbO2需轉移e-的量為0.01 mol。
答案:(1)Pb-2e-+SO![]() ====PbSO4 (2)0.05 mol (3)0.01 mol
====PbSO4 (2)0.05 mol (3)0.01 mol


 快捷英語周周練系列答案
快捷英語周周練系列答案科目:高中化學 來源: 題型:
| 放電 |
| 充電 |
查看答案和解析>>
科目:高中化學 來源: 題型:
已知蓄電池在放電時起原電池的作用,在充電時起電解池的作用。汽車上用的鉛蓄電池是以一組充滿海綿狀灰鉛的鉛板和另一組結構相似的充滿二氧化鉛的鉛板組成。兩個電極用硫酸溶液作電解質溶液。在放電時,兩極發生的反應可分別表示為:
Pb+ SO42-![]() PbSO4+2e-
PbSO4+2e-
PbO2+4H++ SO42-+2e-![]() PbSO4+2H2O
PbSO4+2H2O
充電時,兩極發生的反應分別表示為:
PbSO4+2e-![]() Pb+ SO42-
Pb+ SO42-
PbSO4+2H2O-2e-![]() PbO2+4H++ SO42-
PbO2+4H++ SO42-
根據上述材料,回答(1)—(3)題。
(1)在放電時,下列說法正確的是( )
A.鉛板為電源正極 B.鉛板為電源負極
C.鉛板在放電時發生氧化反應 D.鉛板在放電時發生還原反應
(2)在蓄電池放電時,溶液的pH將( )
A.不變 B.升高 C.降低 D.無法確定
(3)在蓄電池生產和使用時,下列說法正確的是( )
A.生產和使用鉛蓄電池時,不會造成環境污染
B.生產和使用鉛蓄電池時,可能引起鉛中毒和環境污染
C.使用鉛蓄電池時,若鉛板上有1 mol鉛反應就消耗2molH2SO4
D.在使用時,電池內溶液的密度會增大
查看答案和解析>>
科目:高中化學 來源: 題型:
已知蓄電池在放電時起原電池的作用,充電時起電解池的作用。鉛蓄電池在放電和充
電時發生的化學反應可用下式表示:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O據此判斷下列敘述
2PbSO4+2H2O據此判斷下列敘述
正確的是
A.放電時負極電極反應式為:PbO2+4H+ + SO42-+2e-![]() PbSO4+2H2O
PbSO4+2H2O
B.充電時陰極電極反應式為:PbSO4+2e-![]() Pb+SO42-
Pb+SO42-
C.充電時,若要使1molPbSO4轉變為Pb和PbO2,則需要通過2mol電子
D.放電時,H+向負極移動
查看答案和解析>>
科目:高中化學 來源:2012-2013學年福建德化三中高二上學期第二次月考理科化學試卷(帶解析) 題型:單選題
已知蓄電池在放電時起原電池的作用,充電時起電解池的作用。鉛蓄電池在放電和充電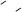 時發生的化學反應可用下式表示:
時發生的化學反應可用下式表示:
據此判斷下列敘述中正確的是 ( )
A.放電時正極電極反應式PbO2 + SO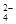 + 2e – + 4 H+= PbSO4 + 2H2O + 2e – + 4 H+= PbSO4 + 2H2O |
| B.充電時蓄電池負極應與電源正極相連接 |
| C.充電時,若要使1mol PbSO4轉變為PbO2,則需要通過4mol電子 |
| D.電池放電時,溶液酸性增強 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com