
| 離子 | Na+ | Mg2+ | Cl- | SO42- |
| 濃度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
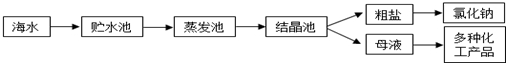
分析 (1)①根據鎂離子用氫氧根離子沉淀,硫酸根離子用鋇離子沉淀,鈣離子用碳酸根離子沉淀,過濾要放在所有的沉淀操作之后,加碳酸鈉要放在加氯化鋇之后,可以將過量的鋇離子沉淀最后再用鹽酸處理溶液中的碳酸根離子和氫氧根離子進行分析;
②根據電解池的工作原理,分析兩個電極上放電的離子,并確定生成的物質,以此書寫電極反應式以及判斷溶液酸堿性;
(2)根據制取純堿的原理:向飽和的氯化鈉溶液中依次通入氨氣、二氧化碳,析出碳酸氫鈉晶體,加熱碳酸氫鈉晶體可制得純堿;
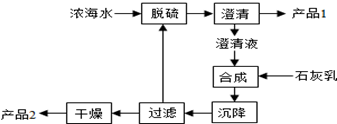
(3)工藝流程合成步驟中加入石灰乳,沉降后,將過濾后的濾液進行脫硫,應是用鈣離子沉淀硫酸根離子生成硫酸鈣沉淀,產品1為硫酸鈣,合成得到氫氧化鎂沉淀,故過濾后干燥的產品2為氫氧化鎂,計算1L溶液中Mg2+的質量,根據Mg2+~Mg(OH)2計算氫氧化鎂的物質的量.
解答 解:(1)①因用蒸發結晶的方法可以從海水中獲得食鹽,鎂離子用氫氧根離子沉淀,加入過量的石灰乳可以將鎂離子沉淀,硫酸根離子用鋇離子沉淀,加入過量的氯化鋇可以將硫酸根離子沉淀,至于先除鎂離子,還是先除硫酸根離子都行,鈣離子用碳酸根離子沉淀,除鈣離子加入碳酸鈉轉化為沉淀,但是加入的碳酸鈉要放在加入的氯化鋇之后,這樣碳酸鈉會除去反應剩余的氯化鋇,離子都沉淀了,在進行過濾,最后再加入鹽酸除去反應剩余的氫氧根離子和碳酸根離子,所以添加試劑的順序為:CBDA或BCDA,
故答案為:CBDA或BCDA;
②電解飽和食鹽水時,與正極相連的陽極發生的反應是2Cl--2e-=Cl2↑,與負極相連的陰極發生的反應是:2H++2e=H2↑,H+不斷消耗,使得溶液中C(OH-)增大,pH變大,
故答案為:2Cl--2e-=Cl2↑;變大;
(2)向飽和的氯化鈉溶液中依次通入氨氣、二氧化碳,則氣體B是二氧化碳,析出碳酸氫鈉晶體,加熱碳酸氫鈉晶體可制得純堿,上述反應的化學方程式分別為:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案為:CO2;NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(3)工藝流程合成步驟中加入石灰乳,沉降后,將過濾后的濾液進行脫硫,用Ca2+沉淀SO42-生成CaSO4沉淀,離子方程式為:Ca2++SO42-=CaSO4↓,采用過濾的方法得到產品1為CaSO4,濾液中加入石灰乳,發生反應為Mg2++2OH-=Mg(OH)2↓,合成中應得到Mg(OH)2沉淀,過濾、干燥的產品2為Mg(OH)2,
溶液中m(Mg2+)=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×$\frac{58g}{24g}$=69.6g,氫氧化鎂的物質的量n[Mg(OH)2]=$\frac{69.6g}{58g/mol}$=1.2mol,
故答案為:Ca2++SO42-=CaSO4↓;1.2.
點評 本題主要以海水化學資源的利用為背景,考查了粗鹽的提純、電解飽和食鹽水、候氏制堿、海水中提取Mg的原理、化學反應計算等知識,題目難度中等,掌握基礎知識為解答關鍵,試題培養了學生運用知識分析問題和解決問題的能力.


科目:高中化學 來源: 題型:解答題
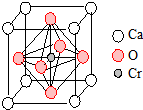 翡翠的主要成分為NaAlSi2O6,還含有其他多種金屬陽離子,其中Cr3+的含量決定其綠色的深淺.
翡翠的主要成分為NaAlSi2O6,還含有其他多種金屬陽離子,其中Cr3+的含量決定其綠色的深淺.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ②④ | C. | ④⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
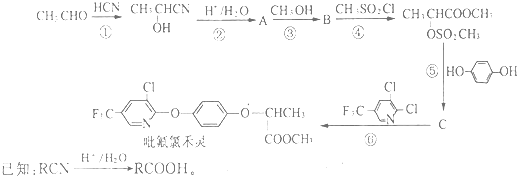
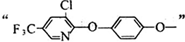
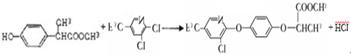 ;
;
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
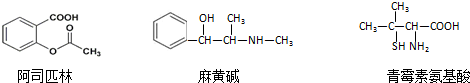
| A. | 三種有機物都能發生酯化反應 | |
| B. | 阿司匹林的苯環上的一氯代物有8種 | |
| C. | 麻黃堿的分子式是C10H15NO,苯環上的一硝基取代物有3種 | |
| D. | 青霉素氨基酸既能與鹽酸反應,又能與NaOH溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 序號 | ① | ② | ③ | ④ |
| 溶液 | 氨水 | NaOH | CH3COOH | HCl |
| 濃度c/mol•L-1 | 0.01 | 0.01 | 0.01 | 0.01 |
| A. | 由水電離出的c(H+):①=②=③=④ | |
| B. | 溶液的pH:②>①>④>③ | |
| C. | ②、③混合呈中性,所需溶液的體積:③>② | |
| D. | ①、④等體積混合,所得溶液中離子的濃度:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
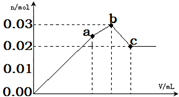 向100mL 0.1mol•L-1硫酸鋁銨[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.隨著Ba(OH)2溶液體積V的變化,沉淀總物質的量n的變化如圖所示.下列說法不正確的( )
向100mL 0.1mol•L-1硫酸鋁銨[NH4Al(SO4)2]溶液中逐滴滴入0.1mol•L-1 Ba(OH)2溶液.隨著Ba(OH)2溶液體積V的變化,沉淀總物質的量n的變化如圖所示.下列說法不正確的( )| A. | a點的溶液呈酸性的原因為:NH4++H2O?NH3•H2O+H+ | |
| B. | c點沉淀的質量比a點沉淀的質量大 | |
| C. | b點加入Ba(OH)2溶液的體積為150mL | |
| D. | 至c點完成反應,反應的離子方程式可表示為:Al3++2SO42-+NH4++2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com