
| A. | 含有鹽酸的潔廁劑和含有次氯酸鈉的消毒液混用可以增強洗滌和消毒的效果 | |
| B. | 過量的Fe和Cu在等物質的量的Cl2中燃燒,轉移的電子數相等 | |
| C. | 等體積、等濃度的NH4Cl溶液和稀氨水中,所含NH4+的數目相等 | |
| D. | 等物質的量的過氧化鋇(BaO2)和Ba(OH)2固體中,陰陽離子個數比均為2:1 |
分析 A.含有鹽酸的潔廁劑主要成分為鹽酸,含有次氯酸鈉的消毒液混用,會在酸溶液中氯離子和次氯酸根離子發生氧化還原反應生成有毒氣體氯氣;
B.過量鐵和銅與等物質的量氯氣反應,反應電子轉移依據反應的氯氣計算;
C.等體積、等濃度的NH4Cl溶液和稀氨水中,一水合氨電離程度大于銨根離子的水解程度,溶液顯堿性,但一水合氨是弱電解質存在微弱電離;
D.過氧化鋇(BaO2) 鋇離子和過氧根離子構成分析;
解答 解:A.含有鹽酸的潔廁劑主要成分為鹽酸,含有次氯酸鈉的消毒液混用,會在酸溶液中氯離子和次氯酸根離子發生氧化還原反應生成有毒氣體氯氣,Cl-+ClO-+2H+=Cl2↑+H2O,不能增強洗滌和消毒的效果,產生有毒氣體引起危險,故A錯誤;
B.過量鐵和銅與等物質的量氯氣反應,反應電子轉移依據反應的氯氣計算,反應的氯氣相同,Cl2~2Cl-~2e-,電子轉移數相同,故B正確;
C.等體積、等濃度的NH4Cl溶液和稀氨水中,一水合氨電離程度大于銨根離子的水解程度,溶液顯堿性,一水合氨是弱電解質存在微弱電離,氯化銨溶液中銨根離子濃度大于一水合氨溶液中銨根離子濃度,故C錯誤;
D.過氧化鋇(BaO2) 鋇離子和過氧根離子構成,陰陽離子個數比均為1:1,故D錯誤;
故選B.
點評 本題考查了氯及其化合物性質、物質結構、氧化還原反應電子轉移計算、弱電解質電離平衡的分析判斷,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 要除去氯化鎂酸性溶液里少量的氯化鐵,可以選用氫氧化鈉 | |
| B. | 鍍錫鐵表面有劃痕是,仍然能阻止鐵被氧化 | |
| C. | 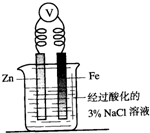 向圖燒杯內的溶液中加入黃色的K3[Fe(CN)6]溶液,一段時間后可看到Fe電極附近有藍色沉淀生成 | |
| D. | 各種原生銅的硫化物經氧化、淋濾作用變成硫酸銅,遇到深層的ZnS和PbS,便慢慢地使之轉變為CuS |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化還原反應的實質是電子轉移 | B. | 氧化劑在反應中本身被還原 | ||
| C. | 氧化反應和還原反應同時進行 | D. | 氧化還原反應一定有單質參加 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1g甲烷和1g氧氣的原子數之比為5:1 | |
| B. | 同溫同壓下甲烷和氧氣的密度之比為2:1 | |
| C. | 等物質的量的甲烷和氧氣的質量之比為2:1 | |
| D. | 在標準狀況下等質量的甲烷和氧氣的體積之比為1:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 |  |  | 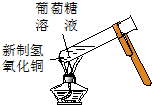 |
| ① | ② | ③ | ④ |
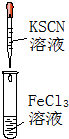
| A. | 實驗①試管中混合溶液中出現紅色沉淀 | |
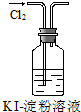
| B. | 實驗②中溶液變黃色 | |
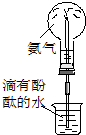
| C. | 實驗③中燒瓶內溶液變紅色 | |
| D. | 實驗④中出現黑色氧化銅固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 裝置 | 現象 | 結論及解釋 |
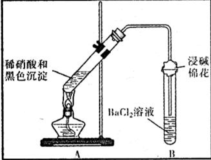 | ①A試管中黑色沉淀逐漸溶解 ②A試管上方出現紅棕色氣體 ③B試管中出現白色沉淀 | a.現象②說明褐色沉淀具有 還原性. b.試管B中產生白色沉淀的總反應的離子方程式為 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該電池放電時,正極的電極反應為O2+4H++4e-═2H2O | |
| B. | 該電池充電時,陰極發生了氧化反應:Li++e-═Li | |
| C. | 電池中的有機電解液可以用稀鹽酸代替 | |
| D. | 正極區產生的LiOH可回收利用 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com