

分析 (1)由圖可知,開始到平衡時甲醇的濃度增加0.75mol/L,結合v=$\frac{△c}{△t}$及速率之比等于化學計量數之比計算;
(2)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
C始 1 3 0 0
C變 0.75 2.25 0.75 0.75
C平 0.25 0.75 0.75 0.75
結合平衡濃度計算K;
(3)能使n(CH3OH)/n(CO2)增大,可使平衡正向移動,但不能增加二氧化碳的量;
(4)①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②H2O(g)=H2O(1)△H=-44.0kJ/mol
由蓋斯定律可知,(①+②×4)×$\frac{1}{2}$得:CH3OH(l)+$\frac{3}{2}$ O2 (g)=CO2(g)+2H2O(l);
(5)以甲醇和空氣為原料,以氫氧化鈉為電解質溶液設計成原電池,負極上甲醇失去電子發生氧化反應生成碳酸根離子;
(6)A.若溶液M呈中性,則溶液中c(H+)=c(OH-)=1×10-7mol•L-1;
B.若V1=V2,HA為強酸時溶液M的pH等于7;
C.若溶液M呈酸性,等體積時HA過量;
D.若等體積時HA過量.
解答 解:(1)由圖可知,開始到平衡時甲醇的濃度增加0.75mol/L,v(H2)=3 v(CO2)=$\frac{0.75mol/L}{10min}$×3=0.225mol/(L•min),
故答案為:0.225;
(2)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
C始 1 3 0 0
C變 0.75 2.25 0.75 0.75
C平 0.25 0.75 0.75 0.75
K=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=5.33,
故答案為:5.33;
(3)A.升高溫度,平衡逆向移動,n(CH3OH)/n(CO2)減小,故不選;
B.恒容時充入He(g),使體系壓強增大,平衡不移動,n(CH3OH)/n(CO2)不變,故不選;
C.將H2O(g)從體系中分離,平衡正向移動,能使n(CH3OH)/n(CO2)增大,故選;
D.再充入lmol CO2和3mol H2,壓強增大,平衡正向移動,能使n(CH3OH)/n(CO2)增大,故選;
故答案為:C D;
(4)①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②H2O(g)=H2O(1)△H=-44.0kJ/mol
由蓋斯定律可知,(①+②×4)×$\frac{1}{2}$得:CH3OH(l)+$\frac{3}{2}$ O2 (g)=CO2(g)+2H2O(l),則△H=-725.8KJ/mol,
即甲醇的燃燒熱化學方程式為CH3OH(l)+$\frac{3}{2}$O2 (g)=CO2(g)+2H2O(l)△H=-725.8KJ/mol,
故答案為:CH3OH(l)+$\frac{3}{2}$O2 (g)=CO2(g)+2H2O(l)△H=-725.8KJ/mol;
(5)以甲醇和空氣為原料,氫氧化鈉為電解質溶液設計成原電池,負極上甲醇失去電子發生氧化反應生成碳酸根離子,負極反應為CH3OH+8OH--6e-=CO32-+6H2O,
故答案為:CH3OH+8OH--6e-=CO32-+6H2O;
(6)A.若溶液M呈中性,則溶液中c(H+)=c(OH-)=1×10-7mol•L-1,則c(H+)+c(OH-)=2×10-7mol•L-1,故A正確;
B.若V1=V2,HA為強酸時溶液M的pH等于7,如HA為弱酸時,HA過量,pH<7,故B錯誤;
C.若溶液M呈酸性,等體積時HA過量,或酸的體積大,則V1≥V2,故C錯誤;
D.若等體積時HA過量,則溶液M呈堿性,則V1一定小于V2,故D正確;
故答案為:AD.
點評 本題考查化學平衡的計算,為高頻考點,把握化學平衡三段法、平衡移動、電極反應、蓋斯定律應用、酸堿混合等為解答的關鍵,側重分析與計算能力的考查,注意利用平衡濃度計算K,綜合性較強,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | Na+、Ba2+、NO3-、Cl- | B. | K+、Na+、H+、Cl- | ||
| C. | K+、NH4+、S2-、CO32- | D. | Cu2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | CH3OH | CH3OCH3 | H2O |
| 濃度/(mol•L-1) | 0.64 | 0.50 | 0.50 |
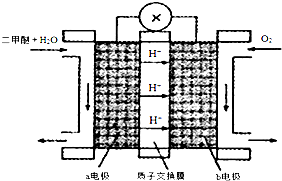
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
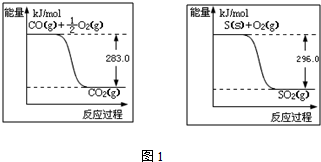
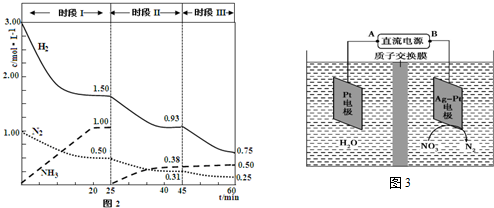
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
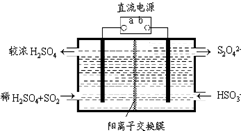 氮和硫的氧化物有多種,其中SO2和NOx都是大氣污染物,對它們的研究有助于空氣的凈化.
氮和硫的氧化物有多種,其中SO2和NOx都是大氣污染物,對它們的研究有助于空氣的凈化.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
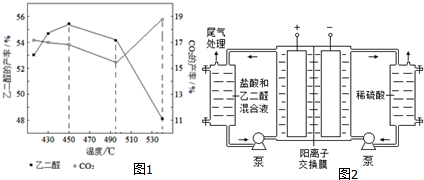
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
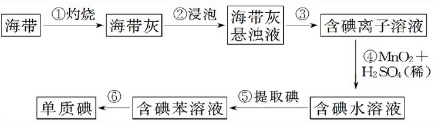
| 密度(g/cm3) | 熔點(.C) | 沸點(.C) | |
| 碘 | 4.93 | 113.5 | 184.35 |
| 苯 | 0.885 | 80.10 | 5.53 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com