
(10分)已知反應:3NO2+H2O==2HNO3+NO,回答下列問題:
(1)該反應的離子方程式為 。
(2)氧化劑與還原劑的質量比為 ,氧化產物與還原產物的物質的量之比為 。
(3)在標準狀況下,3.36L NO2與H2O完全反應轉移的電子數目為 。
(4)寫出HNO3與石灰水反應的離子方程式 。
(10分,每空2分)(1)3NO2+H2O==2H++2NO3-+NO (2分)
(2)1:2 2:1 (4分) (3)0.1mol (2分)(4)(5)H++OH-=H2O (2分)
解析試題分析:(1)NO2和H2O和NO均為氧化物,不能改寫成離子形式,硝酸是強酸,要改寫成離子形式,故為:3NO2+H2O==2H++2NO3-+NO ;(2)NO2中的氮元素有的變成了+5,有的變成了+2,故二氧化氮既做氧化劑,又做還原劑,3mol的NO2中有2mol化合價升高,被氧化,做還原劑,1mol化合價降低,做氧化劑,故氧化劑和還原劑的質量比為1:2,氧化產物是2mol硝酸時,生成1mol的還原產物NO,故物質的量之比為:2:1;(3)標準狀況下的體積除以22,4mol/L得物質的量為0.15mol,其中有0,1mol化合價升高成+5價,失去0.1mol電子,故轉移電子數目為0.1mol;(4)硝酸和石灰水反應的實質是強酸與強堿發生的酸堿中和反應,故為:H++OH-=H2O。
考點:氧化還原反應的概念、離子方程式的書寫等知識。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:單選題
下列離子方程式正確的是
| A.向CuSO4溶液中投入Na:Cu2++2Na=Cu+2Na+ |
| B.向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-=Fe(SCN)3↓ |
| C.向NaHCO3溶液中加過量Ca(OH)2溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D.向BaCO3固體中加入過量的稀H2SO4:BaCO3+2H+=Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列反應的離子方程式正確的是
| A.氯氣與水反應:Cl2+H2O=2H++Cl-+ClO- |
| B.在稀氨水中通入過量CO2:NH3·H2O+CO2=NH4++HCO3- |
| C.用氯化鐵溶液腐蝕電路板:Fe3++Cu=Fe2++Cu2+ |
| D.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(過二硫酸鉀),溶液中會發生如下反應:Mn2++ S2O82-+H2O→MnO4-+SO42一十H+該反應常用于檢驗Mn2+的存在。其特征現象是 。若反應中有0.1 mol還原劑參加反應,則消耗氧化劑的物質的量為 mol。
(2)若該反應所用的硫酸錳改為氯化錳,當它跟過量的過硫酸鉀反應時,除有高錳酸鉀、硫酸鉀、硫酸生成外,其他的生成物還有 。
(3)將NaBiO3固體(黃色微溶)加入到MnSO3和H2SO4的混合溶液里加熱,固體溶解變為澄清溶液,發生如下反應: NaBiO3+ MnSO4+ H2S04→ Na2S04+ Bi2(SO4)3+ NaMnO4+ H2O。
①配平上述反應的化學方程式;
②上述反應中還原產物是 。
③用單線橋表示該氧化還原反應 。
(4)S2O82-在一定條件下,可轉變為S2O32-,寫出往K2S2O3中滴加稀硫酸的離子方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(12分)鹵化物和鹵酸鹽在工業生產中有著重要的作用。某小組為探究其中一些鹽的性質,查閱資料并進行實驗。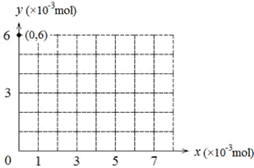
查閱資料如下:
①BrO3-+ 6I-+ 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3-+ I2 = 2IO3-+ Br2
③ IO3-+ 5I-+ 6H+ = 3I2 + 3H2O ④ 2IO3-+ 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
實驗如下:
| 步 驟 | 現 象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的錐形瓶中依次滴入幾滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 隨著KBrO3溶液滴入,溶液由無色變為藍色并逐漸加深,最終保持不變 |
| ⅱ.繼續向上述溶液中滴入KBrO3溶液 | 溶液的藍色逐漸褪去 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分) A、B、C、D、E是位于短周期的主族元素。已知:①熱穩定性:HmD>HmC;②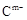 、
、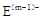 具有相同的電子層結構;③A與B在同一周期,在該周期所有主族元素中,A的原子半徑最大,B的離子半徑最小;④A與B質子數之和是D質子數的3倍。依據上述信息用相應的化學用語回答下列問題:
具有相同的電子層結構;③A與B在同一周期,在該周期所有主族元素中,A的原子半徑最大,B的離子半徑最小;④A與B質子數之和是D質子數的3倍。依據上述信息用相應的化學用語回答下列問題:
HmDm的電子式___________________。(1分)
能證明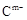 、
、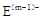 的還原性強弱的離子方程式為__________________________________。
的還原性強弱的離子方程式為__________________________________。
(3)將E的單質通入A與D形成的化合物的水溶液中,其離子方程式為:__________________________。
(4)常溫下,將等物質的量濃度的HmC溶液和A的最高價氧化物對應的水化物溶液等體積混合,寫出該反應的離子方程式 。
在該溶液中溶質中含有的化學鍵類型是 (1分)
(5)在A、B、C、E單質中,符合下列轉化關系的是_____________(填元素符號)。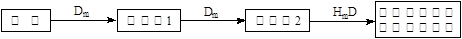
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
中共十八大報告提出:“大力推進生態文明建設”。
① 燃煤是增加大氣PM2.5數值,形成霧霾天氣的罪魁禍首之一。煤的氣化是高效、清潔地利用煤炭的重要途徑,寫出灼熱的焦炭與水蒸氣反應的化學方程式 。
② 餐飲業產生的“地溝油”的主要成分是油脂。綜合利用“地溝油”的一種方法是將“地溝油”中的油脂水解以獲取高級脂肪酸和 (填名稱)。將廢棄塑料進行 處理,可以獲得乙烯、丙烯等化工原料。
③ 防治重金屬污染是2013年全國環保工作的重點。向含有Hg2+的廢水中加入Na2S,可以使Hg2+轉變成沉淀,離子反應方程式為 。
④ 我國生活垃圾一般可分為以下四大類:可回收垃圾、廚余垃圾、有害垃圾和其他垃圾。以下物質屬于可回收垃圾的是 (填字母)。
a. 廢報紙 b. 廢鋁制易拉罐 c. 過期藥品 d. 渣土
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
以冶鋁的廢棄物鋁灰為原料制取超細α-氧化鋁,既降低環境污染又可提高鋁資源的利用率。已知鋁灰的主要成分為Al2O3(含少量雜質SiO2、FeO、Fe2O3),其制備實驗流程如下:
(1)鋁灰中氧化鋁與硫酸反應的化學方程式為 。
(2)圖中“濾渣”的主要成分為 (填化學式)。
(3)加30%的H2O2溶液發生的離子反應方程式為 。
(4)煅燒硫酸鋁銨晶體,發生的主要反應為:
4[NH4Al(SO4)2·12H2O]  2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,將產生的氣體通過下圖所示的裝置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,將產生的氣體通過下圖所示的裝置。
①集氣瓶中收集到的氣體是 (填化學式)。
②足量飽和NaHSO3溶液吸收的物質除大部分H2O(g)外還有 (填化學式)。
③KMnO4溶液褪色(MnO4-還原為Mn2+),發生的離子反應方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
鎢是我國豐產元素。自然界中鎢主要以鎢(+6)酸鹽的形式存在。黑鎢礦的主要成分是鐵和錳的鎢酸鹽(FeWO4、MnWO4)。黑鎢礦傳統冶煉工藝流程圖如下:
(1)已知上述轉化中,除最后一步外,W的化合價未發生變化,則產品C的化學式為 ;如何將其冶煉成單質(用化學方程式表示): 。
根據金屬的活動性不同,金屬的冶煉方法一般有 三種。
(2)寫出第一步轉化中“Mn2+→MnO2”的離子方程式 。
(3)我國鎢化學研究的奠基人顧翼東先生采用另外的反應制得了一種藍色的、非整比的鎢的氧化物WO(3-x)。這種藍色氧化鎢具有比表面大、易還原的優點。一般認為,藍色氧化鎢的顏色和非整比暗示了在化合物中存在正五價和正六價兩種價態的鎢,已知x的值為0.1,則藍色氧化鎢中這兩種價態的鎢原子數之比為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com