
 步步高達標卷系列答案
步步高達標卷系列答案科目:高中化學 來源: 題型:
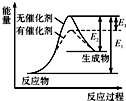 某反應的反應過程中能量變化如圖所示(圖中E1表示正反應的活化能,E2表示逆反應的活化能).下列有關敘述正確的是( )
某反應的反應過程中能量變化如圖所示(圖中E1表示正反應的活化能,E2表示逆反應的活化能).下列有關敘述正確的是( )| A、該反應為放熱反應 | B、該反應的焓變△H=E3 | C、催化劑不能降低逆反應的活化能 | D、該反應逆反應的焓變△H=E2-E1 |
查看答案和解析>>
科目:高中化學 來源:101網校同步練習 高二化學 山東科學技術出版社 魯教版 題型:021
|
關于焓變(ΔH)的敘述正確的是 | |
A. |
ΔH=H(反應產物)-H(反應物) |
B. |
反應熱Qp=ΔH |
C. |
焓變與溫度、壓強有關,與物質的聚集狀態無關 |
D. |
焓的數值大小與物質的量無關 |
查看答案和解析>>
科目:高中化學 來源: 題型:
下列關于焓變ΔH的說法正確的是( )
A.焓變是指1 mol物質參加反應時的能量變化
B.當反應放熱時ΔH>0,反應吸熱時ΔH<0
C.在加熱條件下發生的反應均為吸熱反應
D.在一個化學反應中,當反應物的總能量大于生成物的總能量時,反應放熱,ΔH為“-”
查看答案和解析>>
科目:高中化學 來源:2013-2014學年山東省煙臺市高三上學期期末統考化學試卷(解析版) 題型:填空題
能源的開發、利用與人類社會的可持續發展息息相關,充分利用好能源是擺在人類面前的重大課題。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
則反應4Fe(s)+3O2(g)=2Fe2O3(s)的焓變ΔH= kJ·mol-1。
Ⅱ.依據原電池的構成原理,下列化學反應在理論上可以設計成原電池的是 (填序號)。
A.C(s)+CO2(g)=2CO(g) ΔH>0 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸為電解質溶液,則該原電池的正極反應式為 。
Ⅲ.氫氣作為一種綠色能源,對于人類的生存與發展具有十分重要的意義。
(1)實驗測得,在通常情況下,1 g H2完全燃燒生成液態水,放出142.9 kJ熱量。則H2燃燒的熱化學方程式為 。
(2)用氫氣合成氨的熱化學方程式為N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
①一定條件下,下列敘述可以說明該反應已達平衡狀態的是 。
A.υ正(N2)=υ逆(NH3)
B.各物質的物質的量相等
C.混合氣體的物質的量不再變化
D.混合氣體的密度不再變化
②下圖表示合成氨反應達到平衡后,每次只改變溫度、壓強、催化劑中的某一條件,反應速率υ與時間t的關系。其中表示平衡混合物中的NH3的含量最高的一段時間是 。圖中t3時改變的條件可能是 。

③溫度為T℃時,將4a mol H2和2a mol N2放入0.5 L密閉容器中,充分反應后測得N2的轉化率為50%,則反應的平衡常數為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com