
【題目】氟碳鈰礦(主要成分為CeFCO3)是提取稀土化合物、冶煉鈰的重要礦物原料,根據如圖以氟碳鈰礦為原料提取鈰的工藝流程圖,回答問題:
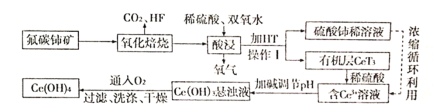
(1)CeFCO3中Ce的化合價為_____;氧化焙燒時不能使用陶瓷容器,原因是______。
(2)氧化焙燒后的產物之一為CeO2,則酸浸時發生反應的離子方程式為_________。
(3)HT是一種難溶于水的有機溶劑,則操作I的名稱為________。
(4)為了提高酸浸率,可以適當提高反應溫度,但溫度偏高浸出率反而會減小,其原因是__________。
(5)已知有機物HT能將Ce3+從水溶液中萃取出來,該過程可表示為:Ce3+(水層)+3HT(有機層)![]() CeT3(有機層)+3H+(水層)。向CeT3(有機層)中加入稀硫酸能獲得較純的含Ce3+水溶液,從平衡角度解釋其原因:________。
CeT3(有機層)+3H+(水層)。向CeT3(有機層)中加入稀硫酸能獲得較純的含Ce3+水溶液,從平衡角度解釋其原因:________。
(6)寫出向Ce(OH)3懸濁液中通入氧氣得到產品Ce(OH)4的化學方程式:________。
(7)298K時,向c(Ce3+)=0.02 mol/L的溶液中加入氫氧化鈉來調節溶液的pH,若反應后溶液pH=10,此時Ce3+是否沉淀完全?______。(要求列式計算,已知:Ksp[Ce(OH)3]=1.0×10-20,c(Ce3+)<1.0×10-5 mol/L視為沉淀完全)。
【答案】+3 陶瓷會與生成的HF反應 2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O 分液 溫度升高,雙氧水發生分解,造成浸出率偏小 向混合液中加入稀硫酸,使c(H+)增大,平衡向生成Ce3+水溶液方向移動 4Ce(OH)3+O2+2H2O=4Ce(OH)4 是
【解析】
氟碳鈰礦主要化學成分為CeFCO3,由流程可知,氧化焙燒生成二氧化碳、HF氣體及CeO2,再加稀硫酸、過氧化氫,發生氧化還原反應:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O,溶液中加入萃取劑HT,操作I為分液將溶液中的Ce3+萃取出來,再加入稀硫酸得含有Ce3+的溶液,調節溶液的pH得到Ce(OH)3沉淀,再經過氧氣氧化發生4Ce(OH)3+O2+2H2O=4Ce(OH)4,過濾、洗滌、干燥可得Ce(OH)4產品,以此來解答。
(1)CeFCO3中CO32-整體顯-2價,F顯-1價,根據化合物中正、負化合價代數和為0,可知Ce的價態為+3價;氧化焙燒時不能使用陶瓷容器,這是由于陶瓷容器中含有SiO2,SiO2與HF發生反應:SiO2+4HF=SiF4↑+2H2O,因此在該流程氧化焙燒時不能使用陶瓷容器;
(2)氧化焙燒后的產物之一為CeO2,酸浸時,CeO2與硫酸、H2O2發生氧化還原反應,產生Ce2(SO4)3、O2、H2O,該反應的離子方程式為2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
(3)操作I是得到溶液和有機相,是分離互不相容的兩層液體物質,因此操作I的名稱為分液;
(4)酸浸時加入H2O2,H2O2不穩定,在高溫下會發生分解,造成浸出率偏小;
(5)該過程中存在Ce3+(水層)+3HT(有機層)![]() CeT3(有機層)+3H+(水層),向混合液中加入稀硫酸,使溶液中c(H+)增大,化學平衡逆向移動,即向生成Ce3+水溶液的方向移動,從而能獲得較純的含Ce3+水溶液;
CeT3(有機層)+3H+(水層),向混合液中加入稀硫酸,使溶液中c(H+)增大,化學平衡逆向移動,即向生成Ce3+水溶液的方向移動,從而能獲得較純的含Ce3+水溶液;
(6)向Ce(OH)3懸濁液中通入氧氣,發生氧化還原反應得到產品Ce(OH)4,該反應的化學方程式為:4Ce(OH)3+O2+2H2O=4Ce(OH)4;
(7)298K時,向c(Ce3+)=0.02 mol/L的溶液中加入NaOH溶液來調節溶液的pH,若反應后溶液pH=10,則c(OH-)=1.0×10-4 mol/L, Ce3+若形成沉淀,c(Ce3+)×c3(OH-)>Ksp[Ce(OH)3],而此時溶液中c(Ce3+)= mol/L=1.0×10-8 mol/L<1.0×10-5 mol/L,因此Ce3+沉淀完全。
mol/L=1.0×10-8 mol/L<1.0×10-5 mol/L,因此Ce3+沉淀完全。


 口算能手系列答案
口算能手系列答案科目:高中化學 來源: 題型:
【題目】1,2—二溴乙烷[BrCH2CH2Br,常溫下為無色液體,難溶于水,密度比水大,熔點9℃,沸點132℃]常用作熏蒸消毒的溶劑。利用以下原理可在實驗室制取:2C2H5OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br。
BrCH2CH2Br。
已知:140℃時發生副反應生成乙醚(C2H5OC2H5),局部過熱會生成SO2、CO2。
實驗步驟如下:
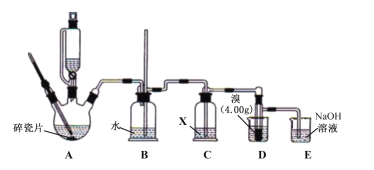
①按如圖組裝儀器(夾持裝置略),檢查氣密性后添加試劑。
②在冰水浴冷卻、攪拌下,將20mL濃硫酸緩慢加到10mL95%乙醇中,取出5mL混合液加入三頸燒瓶中,將剩余部分移入恒壓滴液漏斗。
③加熱A至175℃,打開恒壓滴液漏斗活塞,慢慢滴加混合液至D中液溴反應完全。
④將D中產物移到分液漏斗,依次用水、NaOH溶液、水洗滌并分液,往有機相加入適量MgSO4固體,過濾、操作Y,收集到BrCH2CH2Br4.23g。
請回答以下問題:
(1)B中長導管的作用是___。
(2)試劑X可選用___(填序號)。
a.NaOH溶液 b.飽和NaHSO3溶液 c.酸性高錳酸鉀溶液 d.濃硫酸
(3)D中具支試管還需加入少量水,目的是___。反應過程中需用冷水冷卻具支試管,若將冷水換成冰水,可增強冷卻效果,但主要缺點是___。
(4)步驟②配制混合液使用的玻璃儀器除了量筒,還有___。
(5)與直接將全部混合液加熱到170℃相比,步驟③中往175℃少量混合液中慢慢滴加混合液,最主要的優點是___。
(6)反應結束后,E中溶液檢測到BrO3-,則E中發生反應的離子方程式為___。
(7)步驟④操作Y為___。
(8)BrCH2CH2Br的產率為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量與生成沉淀和氣體的量(縱坐標)的關系如圖所示,則溶液中Mg2+、NH4+、Al3+三種離子的物質的量之比為( )
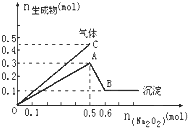
A.1:1:2B.2:2:1C.1:2:2D.9:2:4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究氮氧化物的反應機理,對于消除其對環境的污染具有重要意義。
(1)升高溫度,絕大多數的化學反應速率增大,但是![]() 的反應速率卻隨著溫度的升高而減小。查閱資料得知,該反應歷程分為以下兩步:
的反應速率卻隨著溫度的升高而減小。查閱資料得知,該反應歷程分為以下兩步:
Ⅰ.![]() (快)
(快) ![]()
![]() 正
正![]() 正
正![]()
![]() 逆
逆![]() 逆
逆![]()
Ⅱ.![]() (慢)
(慢) ![]()
![]() 正
正![]() 正
正![]()
![]() 逆
逆![]() 逆
逆![]()
回答:
①反應![]() 的
的![]() ____(用含
____(用含![]() 和
和![]() 的式子表示)。一定溫度下,反應
的式子表示)。一定溫度下,反應![]() 達到平衡狀態,寫出用
達到平衡狀態,寫出用![]() 正、
正、![]() 逆、
逆、![]() 正、
正、![]() 逆表示的平衡常數表達式
逆表示的平衡常數表達式![]() ____。
____。
②決定![]() 反應速率的是反應Ⅱ,則反應Ⅰ的活化能
反應速率的是反應Ⅱ,則反應Ⅰ的活化能![]() 與反應Ⅱ的活化能
與反應Ⅱ的活化能![]() 的大小關系為
的大小關系為![]() ____
____![]() (填“
(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
(2)亞硝酸氯(![]() )是有機合成中重要的試劑,可
)是有機合成中重要的試劑,可![]() 與
與![]() 在一定條件下合成。在
在一定條件下合成。在![]() 容器恒溫條件下,將物質的量之和為
容器恒溫條件下,將物質的量之和為![]() 的
的![]() 和
和![]() 以不同的氮氯比進行如下反應:
以不同的氮氯比進行如下反應:![]()
![]() ,平衡時某反應物的轉化率與氮氯比及不同溫度的關系結果如下圖。
,平衡時某反應物的轉化率與氮氯比及不同溫度的關系結果如下圖。
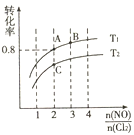
①判斷圖中溫度![]() 、
、![]() 的關系:
的關系:![]() ____
____![]() 。(填“
。(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)
②圖中縱坐標為物質____(填化學式)的轉化率,理由是_____。
③圖中![]() 、
、![]() 、
、![]() 三點中平衡時
三點中平衡時![]() 體積分數最大的是____。(填“
體積分數最大的是____。(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)
”)
④![]() 溫度下,該反應的平衡常數
溫度下,該反應的平衡常數![]() ____。
____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂和鋁分別與等濃度等體積的過量稀硫酸反應,產生氣體的體積(V)與時間(t)的關系如圖所示,則下列關于反應中鎂和鋁的敘述正確的是

A. 二者物質的量之比為3∶2
B. 二者質量之比為3∶2
C. 二者摩爾質量之比為2∶3
D. 二者消耗H2SO4的物質的量之比為2∶3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向50 mL稀H2SO4與稀HNO3的混合溶液中逐漸加入鐵粉,假設加入鐵粉的質量與產生氣體的體積(標準狀況)之間的關系如圖所示,且每一段只對應一個反應。下列說法正確的是( )
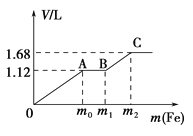
A. 開始時產生的氣體為H2
B. AB段發生的反應為置換反應
C. 參加反應鐵粉的總質量m2=5.6 g
D. 所用混合溶液中c(HNO3)=0.5 molL﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中科院一項新研究成果實現了甲烷高效生產乙烯,其反應為:2CH4(g)![]() C2H4(g)+2H2(g) ΔH>0
C2H4(g)+2H2(g) ΔH>0
物質 | 燃燒熱(kJ/mol) |
氫氣 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.5 |
(1)已知相關物質的燃燒熱如表,完成熱化學方程式:2CH4(g)![]() C2H4(g)+2H2(g) ΔH=__。
C2H4(g)+2H2(g) ΔH=__。
(2)溫度為T1℃時,向1 L的恒容反應器中充入2 mol CH4,僅發生上述反應,反應0~15 min CH4的物質的量隨時間變化如圖1,實驗測得10~15 min時H2的濃度為1.6 mol/L。

①若圖1中曲線a、b分別表示在T1℃時,使用等質量的兩種不同的催化劑時,達到平衡過程中n(CH4)變化曲線,判斷:催化劑a_____b(填“優于”或“劣于”)。
②在15 min時改變反應條件,導致n(CH4)發生變化(見圖1),則改變的條件可能是:_____(任答一條即可)。
(3)實驗測得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),其中k正、k逆為速率常數僅與溫度有關,溫度為![]() 時,k正與k逆的比值為______(填數值)。若將溫度由T1升高到T2,則反應速率增大的倍數v正_______ v逆(填“>”、“=”或“<”),判斷的理由是_________。
時,k正與k逆的比值為______(填數值)。若將溫度由T1升高到T2,則反應速率增大的倍數v正_______ v逆(填“>”、“=”或“<”),判斷的理由是_________。
(4)科研人員設計了甲烷燃料電池并用于電解(如圖2)。電解質是摻雜了Y2O3與ZrO2的固體,可在高溫下傳導O2-。
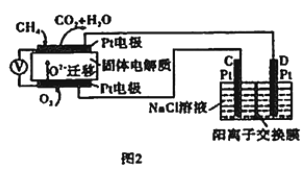
①圖中C處的Pt為_______(填“陰”或“陽”)極。
②該電池工作時負極的電極反應式為________。
③用該電池電解飽和食鹽水,一段時間后收集到標準狀況下氣體總體積為112 mL,則陰極區所得溶液在25℃時pH=_______(假設電解前后NaCl溶液的體積均為500 mL)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對下列探究反應速率和化學平衡影響因素的四個實驗,回答下列問題:
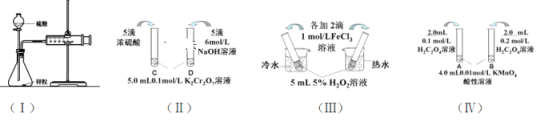
(1)利用實驗(Ⅰ)探究鋅與1mol/L硫酸和4mol/L硫酸反應的速率,可以測定收集一定體積氫氣所用的時間。①此方法需要控制的變量有(至少寫出兩項):___。②為了衡量反應的快慢,還可以采用新的測定方法是_____。
(2)實驗(Ⅱ)已知:Cr2O72- (橙色)+ H2O![]() 2CrO42-(黃色)+ 2H+。D試管中實驗現象為_______________________________,用平衡移動原理解釋原因:_______________________
2CrO42-(黃色)+ 2H+。D試管中實驗現象為_______________________________,用平衡移動原理解釋原因:_______________________
(3)實驗(Ⅲ)①實驗目的是探究____________________。
(4)在室溫下進行實驗(Ⅳ)①實驗目的是_____。②溶液褪色的時間:t(A)________t(B)(填>、<或= )
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硝酸銨是一種常用的化肥,其工業生產流程如圖,請回答下列問題。
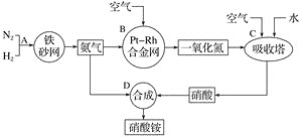
(1)寫出反應容器B中發生反應的化學方程式:____。
(2)吸收塔C中通入空氣的目的是___;C、D兩個反應容器中發生的反應,屬于氧化還原反應的是___(填反應容器代號)。
(3)濃硝酸一般保存在棕色試劑瓶里,并放置在陰涼處,用化學方程式解釋原因:___。
(4)碳與濃硝酸反應的化學方程式是_____。
(5)將128g銅置于一定量的濃硝酸中并微熱。當銅片完全消失時,共收集到NO2和NO的混合氣體44.8L(標準狀況)。
①寫出上述過程中,有關反應的離子方程式:____、____。
②完成該反應至少需要量取10mol·L-1的濃硝酸_____mL。
③混合氣體中NO2的體積為____L,NO的體積為____L(均為標準狀況下)。
④將收集上述氣體的容器倒扣在盛有水的水槽中,并向其中緩慢通入O2使其充分反應,若要使溶液恰好充滿容器,則理論上需要參加反應的O2的物質的量為____mol。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com