
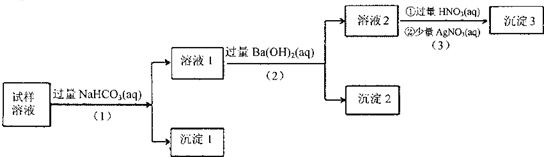
| A. | 沉淀2放置在空氣中,若質量增加,試樣中肯定存在SO32- | |
| B. | 試樣溶液中加人稍過量的NH4C1溶液能得到與沉淀1成分相同的物質 | |
| C. | 上述流程步驟(1)(2)(3)的順序改為(3)(2)(1),可能會獲得相同的實驗現象 | |
| D. | 試樣溶液中肯定存在A102-、Cl-,其中Na+、K+至少存在1種 |
分析 溶液加入過量的溶液后,生成沉淀1,由題意可知原溶液中一定有AlO2-;所得溶液I中加入過量的Ba(OH)2溶液后,生成沉淀2,則沉淀2可能為BaCO3和BaSO3或兩者其一即原溶液中一定含有CO32-和SO32-或兩者之一,則溶液2中可能有:Na+、K+、Cl-,一定含Ba2+、OH-,加入過量的硝酸和硝酸銀,生成沉淀3,則說明原溶液中含Cl-,由于溶液一定呈電中性,則溶液中一定含Na+和K+或兩者中的一種,以此解答該題.
解答 解:溶液加入過量的溶液后,生成沉淀1,由題意可知原溶液中一定有AlO2-;所得溶液I中加入過量的Ba(OH)2溶液后,生成沉淀2,則沉淀2可能為BaCO3和BaSO3或兩者其一即原溶液中一定含有CO32-和SO32-或兩者之一,則溶液2中可能有:Na+、K+、Cl-,一定含Ba2+、OH-,加入過量的硝酸和硝酸銀,生成沉淀3,則說明原溶液中含Cl-,由于溶液一定呈電中性,則溶液中一定含Na+和K+或兩者中的一種,
A.沉淀2可能為BaCO3和BaSO3或兩者中的一種,BaSO3放置在空氣中會被氧化為BaSO4,則質量會增加,故沉淀2放置在空氣中,若質量增加,試樣中肯定操作SO32-,故A正確;
B.由于溶液中一定含AlO2-,故向試樣溶液中加入稍過量的NH4Cl溶液,AlO2-能和NH4+發生雙水解得到Al(OH)3,故B正確;
C.由于溶液中一定含AlO2-和Cl-,一定含有CO32-和SO32-或兩者之一,一定含Na+和K+或兩者中的一種,故先向溶液中加入過量稀硝酸,會將CO32-反應掉,將AlO2-反應為Al3+,將SO32-氧化為SO42-,再加少量硝酸銀,會生成AgCl和Ag2SO4沉淀,則所得的溶液中一定含Na+和K+或兩者中的一種,一定含Al3+、NO3-,再向溶液中加入過量的Ba(OH)2溶液,Al3+遇過量的OH-生成AlO2-,無沉淀生成;所得溶液中一定含Na+和K+或兩者中的一種,一定含AlO2-和NO3-,再加入過量的NaHCO3,會生成Al(OH)3沉淀,故步驟(1)(2)(3)的順序改為(3)(2)(1),實驗現象不同,故C錯誤;
D.由以上分析可知試樣溶液中肯定操作AlO2-、Cl-,其中Na+、K+至少操作1種,故D正確.
故選C.
點評 本題考查離子的檢驗方法,為高頻考點,側重學生的分析能力的考查,注意掌握常見離子的性質及檢驗方法,要求學生能夠根據反應現象判斷離子存在情況,試題培養了學生靈活應用所學知識的能力,難度不大.


 互動課堂系列答案
互動課堂系列答案 激活思維智能訓練課時導學練系列答案
激活思維智能訓練課時導學練系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(3d)>E(4s) | D. | E(5s)>E(4s)>E(4f) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 丙烷是液化石油氣的主要成分,在燃燒時能放出大量的熱,作為能源廣泛應用于生產和日常生活中.
丙烷是液化石油氣的主要成分,在燃燒時能放出大量的熱,作為能源廣泛應用于生產和日常生活中.| 容器 編號 | 起始時各物質 的物質的量/mol | 達到平衡 的時間/min | 達到平衡時 體系能量的 變化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| A | 1.5 | 1.9 | 0 | 0 | ta | 放出熱量:36.9 |
| B | 3 | 3.8 | 0 | 0 | tb | 放出熱量:Q |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 合成氨反應在低溫下能夠自發進行,是因為反應物鍵能之和大于生成物鍵能之和 | |
| B. | 元素分析儀可以確定物質中是否含有C、H、O、N、S、Cl、Br等元素,原子吸收光譜可以確定物質中含有哪些金屬元素 | |
| C. | 人們利用元素周期律在過渡元素中尋找各種性能優良的催化劑,以降低化學反應的活化能,從而起到很好的節能效果 | |
| D. | 超高分辨率熒光顯微鏡能夠觀察到納米尺度的物質,用它可以獲得蛋白質溶液中的分子圖象 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1、2 | B. | 2、3 | C. | 3、6 | D. | 4、6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 亞磷酸(H3PO3)可用作檢測汞、金、銀、鉛、碘酸等的分析試劑.
亞磷酸(H3PO3)可用作檢測汞、金、銀、鉛、碘酸等的分析試劑.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 上述元素中,Y的原子半徑最大 | |
| B. | 上述元素中,W的氣態氫化物最穩定 | |
| C. | 元素W和X可形成含有極性鍵的極性分子WX3 | |
| D. | 工業上可用電解熔融的Y、Z的化合物的方法冶煉Y、Z的單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素Z可與元素X形成共價化合物XZ2 | |
| B. | 元素X與氫形成的原子比為1:1的化合物有很多種 | |
| C. | 元素Y的單質與氫氧化鈉溶液或鹽酸反應均有氫氣生成 | |
| D. | 元素W、X的氯化物中,各原子均滿足8電子的穩定結構 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com