
分析 根據①②可知,氧化性:Cl2>Fe3+>I2,還原性:I->Fe2+>Br-,
(1)還原性Fe2+>Br-,通入氯氣先發生反應2Fe2++Cl2═2Fe3++2Cl-,Fe2+反應完畢,剩余的氯氣再發生反應2Br-+Cl2═Br2+2Cl-,反應后溶液中Cl-和Br-的物質的量濃度相等,說明氯氣完全反應,Cl2的物質的量為:$\frac{3.36L}{22.4L/mol}$=0.15mol,若Br-沒有反應,溶液中n(Br-)=0.3mol,則n(FeBr2)=0.15mol,0.15molFe2+只能消耗0.075mol的Cl2,故有部分Br-參加反應,設FeBr2的物質的量為x,表示出參加反應的n(Br-),根據電子轉移守恒列方程計算x值,再根據c=$\frac{n}{V}$計算;
(2)與相同氧化劑反應時,還原性越強的離子越先參加氧化還原反應,根據其還原能力大小順序知,離子被氧化順序是I->Fe2+>Br-,再結合氧化還原反應分析解答;
(3)要保證溶液中含有兩種陽離子,則亞鐵離子被氧化,且只能部分被氧化,則碘離子完全反應,溴離子不參與反應,據此進行討論.
解答 解:根據①②可知,氧化性:Cl2>Fe3+>I2,還原性:I->Fe2+>Br-,
(1)還原性Fe2+>Br-,通入氯氣先發生反應2Fe2++Cl2═2Fe3++2Cl-,Fe2+反應完畢,剩余的氯氣再發生反應2Br-+Cl2═Br2+2Cl-,反應后溶液中Cl-和Br- 的物質的量濃度相等,說明氯氣完全反應,Cl2的物質的量為:$\frac{3.36L}{22.4L/mol}$=0.15mol,若Br-沒有反應,n(Br-)=0.3mol,則n(FeBr2)=0.15mol,0.15molFe2+只能消耗0.075mol的Cl2,故有部分Br-參加反應,
設FeBr2的物質的量為x,則n(Fe2+)=x mol,n(Br-)=2x mol,未反應的n(Br-)=0.3 mol,參加反應的n(Br-)=(2x-0.3)mol,根據電子轉移守恒有x×1+[2x-0.3]×1=0.15mol×2,解得:x=0.2 mol,
所以原FeBr2溶液的物質的量濃度為:$\frac{0.2mol}{0.1L}$=2mol/L,
故答案為:2mol/L;
(2)與相同氧化劑反應時,還原性越強的離子越先參加氧化還原反應,根據其還原能力大小順序知,離子被氧化順序是I->Fe2+>Br-,溶液中n(I-)=2mol,n(Fe2+)=3mol,n(Br-)=4mol,I-優先反應,其次是Fe2+,最后是Br-,
Cl2+2I-=I2+2Cl-
1mol2mol 2mol
1mol2mol 2mol
2Fe2++Cl2=2Fe3++2Cl-
2mol 1mol 2mol
3mol 1.5mol 3mol
2Br-+Cl2=2Cl-+Br2
2mol 1mol 2mol
1mol 0.5mol1mol
通過以上分析知,I-、Fe2+完全被氧化,Br-有3mol被氧化,根據方程式知,溶液中存在的離子是:Fe3+、Br-、Cl-,
根據原子守恒知,n(C1-)=3n( Cl2)=6mol,n(Br-)=3mol,n(Fe3+)=3mol,
溶液溶液中各種離子物質的量之比為:n(Fe3+):n(Br-):n(C1-)=3mol:3mol:6mol=1:1:2,
故答案為:n(Fe3+):n(Br-):n(C1-)=1:1:2;
(3)向含和溶液中通入c mol Cl2,若要保證溶液中含有兩種陽離子,說明反應后溶液中含有鐵離子和亞鐵離子,即:亞鐵離子只能部分被氧化,根據還原性I->Fe2+>Br-可知,I-完全被氧化,Fe2+部分被氧化,Br-沒有參與反應,
a molFeI2中含有2amolI-、amolFe2+,bmol FeBr2中含有bmolFe2+,故溶液中總共含有(a+b)molFe2+,
根據反應Cl2+2I-=I2+2Cl-、2Fe2++Cl2=2Fe3++2Cl-可知,氧化2amol碘離子需要消耗amol氯氣,氧化(a+b)molFe2+,需要消耗0.5(a+b)mol氯氣,
當溶液中鐵離子和亞鐵離子同時存在時,即亞鐵離子部分被氧化,氯氣的物質的量范圍為:a<c<(1.5a+0.5b),
故答案為:a<c<(1.5a+0.5b).
點評 本題考查了氧化還原反應的計算、有關范圍討論的計算,題目難度中等,明確粒子氧化性、還原性強弱為解答關鍵,注意掌握討論法在化學計算中的應用方法,試題培養了學生的分析能力及化學計算能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 氯化鈉和鐵的熔化 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 碘和干冰的升華 | D. | 食鹽和冰的熔化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
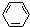 、④HCHO.其中碳原子采取sp2雜化的分子有①③④(填物質序號),HCHO分子的立體結構為平面三角形,它加成產物的熔、沸點比CH4的熔、沸點高,其主要原因是(須指明加成產物是何物質)加成產物CH3OH分子之間能形成氫鍵.
、④HCHO.其中碳原子采取sp2雜化的分子有①③④(填物質序號),HCHO分子的立體結構為平面三角形,它加成產物的熔、沸點比CH4的熔、沸點高,其主要原因是(須指明加成產物是何物質)加成產物CH3OH分子之間能形成氫鍵.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 40g SO3氣體所占有的體積為11.2L | |
| B. | 1mol固體NaHCO3所含有的陰陽離子總數為3NA | |
| C. | 1mol/L的CH3COOH溶液中,CH3COO-總數小于NA | |
| D. | 常溫常壓下,32gO2和O3的混合氣體含氧原子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
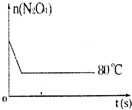 在80℃時,0.40mol的N2O4氣體充入2L已經抽空的固定容積的密閉容器中發生如下反應:N2O4?2NO2 △H>0,隔一段時間對該容器內的物質進行分析,得到如下數據:
在80℃時,0.40mol的N2O4氣體充入2L已經抽空的固定容積的密閉容器中發生如下反應:N2O4?2NO2 △H>0,隔一段時間對該容器內的物質進行分析,得到如下數據:| 時間(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 步驟(1)產物中殘留的苯酚可用FeCl3溶液檢驗 | |
| B. | 步驟(2)產物中殘留的烯丙醇可用溴水檢驗 | |
| C. | 苯氧乙酸和菠蘿酯均可與NaOH溶液發生反應 | |
| D. | 苯酚和菠蘿酯均可與酸性KMnO4溶液發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.3 g Na被O2完全氧化生成Na2O和Na2O2混合物時,失去電子數為0.1~0.2 NA | |
| B. | 常溫下,64 g SO2所含的氧原子數為2NA | |
| C. | 標準狀況下,等物質的量的SO2和SO3所占體積相同 | |
| D. | 100 mL 0.1 mol•L-1的硫酸鋁溶液中含有的Al3+為0.02NA個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (1)(2)(3)(4)(5) | B. | (3)(1)(4)(2)(5) | C. | (5)(1)(3)(2)(4) | D. | (5)(4)(3)(2)(1) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素代號 | W | R | X | Y | Z |
| 原子半徑/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合價 | +1 | +1 | -2 | -3、+5 | +2、+4 |
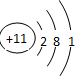
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com