
| HA | H2B | H2C | H3D |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
分析 弱酸的電離平衡常數越大,弱酸的酸性越強,據電離平衡常數可知酸性H3D>HA>H2B>H2C>H2D->HB->HC->HD2-,據此分析.
解答 解:(1)多元弱酸一級電離生成的氫離子會抑制二級電離,所以多元弱酸的二級電離程度遠小于一級電離,
故答案為:多元弱酸一級電離生成的氫離子會抑制二級電離;
(2)弱酸的電離平衡常數越大,弱酸的酸性越強,據電離平衡常數可知酸性H3D>HA>H2B>H2C,故答案為:H3D;H2C;
(3)酸性HA>H2B>HB-,所以向10mL 0.01mol/L Na2B溶液中逐滴加入10mL 0.01mol/L HA溶液,并充分攪拌,反應生成NaHB和NaA,離子方程式為B2-+HA=HB-+A-,
故答案為:B2-+HA=HB-+A-;
(4)將等物質的量的HA、H2B、H2C、NaH2D溶于水配成混合溶液,若逐滴加入燒堿溶液,酸性強的酸首先反應,酸性最弱的最后反應,所以最先與燒堿反應的離子方程式是H3D+OH-=H2O+H2D-,最后與OH-反應的離子是HD2-+OH-=H2O+D3-,故答案為:H3D+OH-=H2O+H2D-;HD2-+OH-=H2O+D3-.
點評 本題考查了據弱酸的電離平衡常數判斷弱酸酸性強弱以及強酸制取弱酸的相關知識,題目難度不大.


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 4 | B. | 6 | C. | 8 | D. | 10 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CaCO3在水中的溶解度很小,其水溶液電阻率很大,所以CaCO3是弱電解質 | |
| B. | CaCO3在水中溶解度很小,但溶于水的CaCO3全部電離,所以CaCO3是強電解質 | |
| C. | 強電解質溶液的導電能力一定強,弱電解質溶液的導電能力一定弱 | |
| D. | 液態SO2不導電,但溶于水后導電,所以SO2是電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | pH=1的溶液中:Mg2+,CO${\;}_{3}^{2-}$,SO${\;}_{4}^{2-}$,Na+ | |
| B. | c(Fe3+)=0.1mol•L-1的溶液中:K+,SO${\;}_{4}^{2-}$,OH- | |
| C. | 使石蕊試液變藍色的溶液中:Mg2+,Cl-,K+ | |
| D. | 使酚酞變紅的溶液中:Na+,Cl-,SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | Na2CO3晶體 | B. | CH3COONa晶體 | C. | Na2SO4溶液 | D. | NaNO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
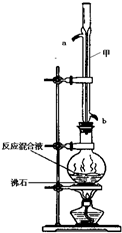 苯甲酸甲酯是一種重要的工業原料,某化學小組采用如圖裝置,以苯甲酸、甲醇為原料制取苯甲酸甲酯.有關物質的物理性質見下表所示:
苯甲酸甲酯是一種重要的工業原料,某化學小組采用如圖裝置,以苯甲酸、甲醇為原料制取苯甲酸甲酯.有關物質的物理性質見下表所示:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔點/℃ | 122.4 | -97 | -12.3 |
| 沸點/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com