
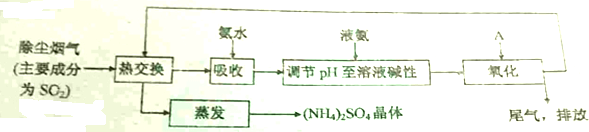
分析 除塵煙氣主要成分為二氧化硫,二氧化硫中+4價硫具有還原性,能被氧化劑氧化成三氧化硫,試劑A最佳選擇為氧氣,因氧氣是空氣的組成,原料充足,且使用成本低,符合工業生產的需要,進行熱交換,便于氨水吸收,氨水和二氧化硫反應生成亞硫酸氫銨,使用液氨調節pH,NH3+HSO3-=NH4++SO32-,經過A氧化,生成硫酸銨,經過熱交換,蒸發得到硫酸銨晶體.
(1)二氧化硫和氨氣和水反應生成亞硫酸銨、亞硫酸氫銨;
(2)調節pH使用的試劑為液氨,氨氣呈堿性,氨氣和亞硫酸氫根離子反應生成正鹽;
(3)工業生產原料需豐富,且使用成本低廉;以氧氣為氧化劑,能將+4價的硫氧化成+6價;
(4)煙氣的溫度很高,經過熱交換后,溶劑蒸發,溶液變過飽和溶液析出溶質;通過熱交換,充分利用熱能,達到節能的效果;
(5)含氮的鹽可作氮肥;
(6)褐煤中的硫含S最高為7%(質量分數),產生的二氧化硫98%被吸收,根據硫元素守恒n(SO2)=n[(NH4)2SO4)]解答.
解答 解:除塵煙氣主要成分為二氧化硫,二氧化硫中+4價硫具有還原性,能被氧化劑氧化成三氧化硫,試劑A最佳選擇為氧氣,因氧氣是空氣的組成,原料充足,且使用成本低,符合工業生產的需要,進行熱交換,便于氨水吸收,氨水和二氧化硫反應生成亞硫酸氫銨,使用液氨調節pH,NH3+HSO3-=NH4++SO32-,經過A氧化,生成硫酸銨,經過熱交換,蒸發得到硫酸銨晶體.
(1)二氧化硫為酸性氧化物,氨氣為堿性氣體,吸收過程中可能發生:2NH3+SO2+H2O=(NH4)2SO3、NH3+SO2+H2O=NH4HSO3,所以吸收過程中可能產生的物質為:(NH4)2SO3、NH4HSO3,
故答案為:(NH4)2SO3、NH4HSO3;
(2)氨氣呈堿性,氨氣和亞硫酸氫根離子反應:NH3+HSO3-=NH4++SO32-,故答案為:NH3+HSO3-=NH4++SO32-;
(3)經過A氧化,生成硫酸銨,需選擇氧化劑,因氧氣是空氣的組成,原料充足,且使用成本低,符合工業生產的需要,以氧氣為氧化劑,亞硫酸銨和氧氣反應2(NH4)2SO3+O2=2(NH4)2SO4,生成硫酸銨,
故答案為:C;2(NH4)2SO3+O2=2(NH4)2SO4;
(4)煙氣的溫度很高,經過熱交換后溶劑蒸發,溶液變過飽和溶液,飽和后溶質結晶,通過熱交換,充分利用熱能,
故答案為:溶液受熱蒸發,飽和后溶質結晶;節能;
(5)硫酸銨為含氮元素的鹽,可作植物生成的化肥,故答案為:化肥;
(6)褐煤中的硫含S最高為7%(質量分數),褐煤10噸可以去除煙氣中98%的SO2,則被除去的二氧化硫的物質的量為n(S)=n(SO2)=$\frac{10×1{0}^{6}×7%×98%g}{32g/mol}$,根據硫元素守恒n(SO2)=n[(NH4)2SO4)]=$\frac{10×1{0}^{6}×7%×98%g}{32g/mol}$,最多可制得產品=$\frac{10×1{0}^{6}×7%×98%g}{32g/mol}$×132g/mol×10-6t/g=2.83噸,故答案為:2.83.
點評 本題考查煙氣中的SO2的處理,掌握二氧化硫、氨氣的性質是解答本題的關鍵,較好的考查學生分析問題、解決問題的能力,注意根據守恒思想解答(6),題目難度中等.


科目:高中化學 來源: 題型:選擇題
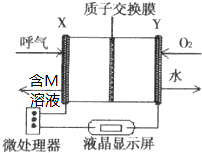 查處酒后駕駛所采用的“便攜式乙醇測量儀”,以燃料電池為工作原理,如圖,兩電極材料均為Pt.理論上乙醇可以被完全氧化為CO2,但實際乙醇被氧化為M,其中一個電極的反應式為:CH3CH2OH-2e-→M+2H+.下列說法中正確的是( )
查處酒后駕駛所采用的“便攜式乙醇測量儀”,以燃料電池為工作原理,如圖,兩電極材料均為Pt.理論上乙醇可以被完全氧化為CO2,但實際乙醇被氧化為M,其中一個電極的反應式為:CH3CH2OH-2e-→M+2H+.下列說法中正確的是( )| A. | 電池內部H+向X極移動 | |
| B. | 另一極Y極的電極反應式為:O2+4e-+2H2O=4OH- | |
| C. | 乙醇在X極上發生還原反應,電子經過外電路流向Y極 | |
| D. | 電池總反應為:2CH3CH2OH+O2→2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
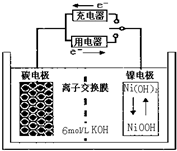
| A. | 充電時碳電極上發生還原反應 | |
| B. | 充電時Ni電極與電源的正極相連 | |
| C. | 放電時碳電極反應為H2-2e-=2H+ | |
| D. | 放電時Ni電極反應為Na(OH)+H2O+e-=Ni(OH)2+OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,晶體類型為分子晶體.
,晶體類型為分子晶體.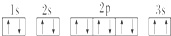 ,該同學所畫的電子排布圖違背了泡利原理.
,該同學所畫的電子排布圖違背了泡利原理.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 往淡水中加入NaCl等配成人造海水,可用于海產品的長途運輸 | |
| B. | 氫氧化鎂分解時吸收大量熱量,可添加到合成樹脂中做阻燃劑 | |
| C. | 酒精能使蛋白質變性,無水酒精在醫學上常被用于消毒 | |
| D. | 利用糧食釀酒經過了淀粉→葡萄糖→乙醇的化學變化過程 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 物質 | 雜質 | 試劑 | 方法 | |
| A | 甲烷 | 乙烯 | 酸性高錳酸鉀溶液 | 洗氣 |
| B | 氯化亞鐵溶液 | 氯化鐵 | 過量鐵粉 | 過濾 |
| C | 苯 | 溴 | 足量NaI溶液 | 分液 |
| D | 乙酸乙酯 | 乙酸 | 飽和碳酸鈉溶液 | 蒸餾 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
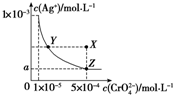
| A. | T℃時,在Y點和Z點,Ag2CrO4的Ksp相等 | |
| B. | 向飽和AgCrO4溶液中加入固體K2CrO4不能使溶液由Y點變為X點 | |
| C. | T℃時,Ag2CrO4的Ksp為1×10-8 | |
| D. | 圖中a=$\sqrt{2}$×10-4 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

| 溫度/℃ | 250 | 350 |
| K | 2.041 | x |
| c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com