
| A. | 為提高反應速率,可換用98%的濃硫酸 | |
| B. | 在反應過程中,水的電離程度逐漸增大 | |
| C. | 在反應體系中加入硫酸鈉溶液,反應速率不變 | |
| D. | 在反應體系中加入少量醋酸鈉固體,反應速率變慢,生成氫氣的量減少 |
分析 A.濃硫酸和Zn反應生成二氧化硫而不是氫氣;
B.酸或堿抑制水電離,含有弱離子的鹽促進水電離;
C.加入硫酸鈉溶液,氫離子濃度降低;
D.加入醋酸鈉固體時,稀硫酸和醋酸反應生成醋酸,溶液中氫離子濃度減小,反應速率降低,但最終電離出氫離子物質的量不變.
解答 解:A.濃硫酸和Zn反應生成二氧化硫而不是氫氣,所以不能用濃硫酸通過改變濃度來制取氫氣,故A錯誤;
B.酸或堿抑制水電離,含有弱離子的鹽促進水電離,隨著反應進行,溶液中氫離子濃度減小、硫酸鋅濃度增大,所以在反應過程中,水的電離程度逐漸增大,故B正確;
C.加入硫酸鈉溶液,氫離子濃度降低,所以反應速率減小,故C錯誤;
D.加入醋酸鈉固體時,稀硫酸和醋酸反應生成醋酸,溶液中氫離子濃度減小,反應速率降低,但最終電離出氫離子物質的量不變,則生成氫氣總量不變,故D錯誤;
故選B.
點評 本題考查化學反應速率影響因素,為高頻考點,明確濃度對反應速率影響原理是解本題關鍵,注意濃硫酸性質的特殊性,易錯選項是A,注意D中生成氫氣總量與電解質強弱無關,題目難度不大.


 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在密閉容器中加入1mol N2和3mol H2,充分反應生成NH3分子數為2NA | |
| B. | 0.1mol-NH2(氨基)中含有的電子數為0.7NA | |
| C. | 30g SiO2中含有的Si-O鍵數目為2NA | |
| D. | 標準狀況下,4.48 L N2所含的共用電子對數0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,請補充完整:
,請補充完整: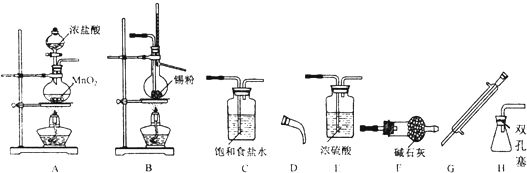
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、NH4+、NO3-、MnO4- | B. | Na+、NO3?、SO42?、I? | ||
| C. | K +、Fe3+、Cl-、Br- | D. | Ba2+、Na+、OH-、CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某氣體通入品紅溶液中,能使其褪色,則該氣體為二氧化硫 | |
| B. | 向Fe(NO3)2溶液中滴加稀鹽酸溶液變成黃色 | |
| C. | 某無色溶液中加入鹽酸酸化的BaCl2溶液有白色沉淀生成,則原溶液中含有SO42- | |
| D. | 鈉在空氣中燃料產物為白色固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 食醋-C2H5OH | B. | 明礬-KAl(SO4)2 | C. | 蘇打-NaHCO3 | D. | 生石灰-CaO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 存在電離平衡、水解平衡和沉淀溶解平衡 | |
| B. | c(Na+)=c(Cl-)>c(HCO3-)>c(CO32-)=c(Ca2+) | |
| C. | c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-) | |
| D. | 反應的離子方程式:2HCO3-+Ca2+═CaCO3↓+H2CO3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com