
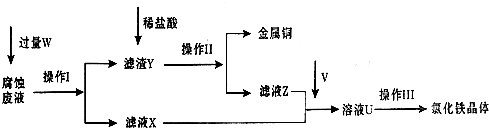
在FeCl3溶液蝕刻銅箔制造電路板的工藝中,廢液處理和資源回收的過程簡述如下,請回答下列問題:

(1)請寫出FeCl3溶液與銅反應的離子方程式: ;操作Ⅰ加入的試劑W是 。
(2)操作Ⅱ之前最好加入適量稀鹽酸,某同學用10mol• L-1 的濃鹽酸配制250mL 1mol• L-1 的稀鹽酸,并進行有關實驗。
①需要量取濃鹽酸 mL。
②配制該稀鹽酸時除量筒、燒杯、玻璃棒外,還必須用到的儀器有 、 。
③用已知濃度的氫氧化鈉溶液滴定稀鹽酸,滴定過程中眼睛應注視 ,實驗時未用標準液潤洗滴定管,測得錐形瓶中待測液的濃度 實際濃度。(填“>”、“<”或“=”)。
(3)操作Ⅲ前需要通入氣體V,請寫出實驗室制取氣體V的化學方程式: ,該反應中 是氧化劑。
(4)操作Ⅲ應在HCl氣流氛圍中進行,其原因是 。
(5)若通入的V的量不足,則最后制得的氯化鐵晶體不純凈,這是因為溶液U中含有雜質 。請設計合理的實驗,驗證溶液U中的成分,并判斷通入的V的量是否不足 (簡要說明實驗步驟、現象和結論)。
供選擇的試劑:酸性KMnO4溶液、KSCN溶液、氯水。
(6)若向氯化鐵溶液中加入一定量石灰水,調節溶液pH,可得紅褐色沉淀。該過程中調節溶液的pH為5,則金屬離子濃度為 。(己知:Ksp[Fe(OH)3]= 4.0×10-38)
(1)2Fe3+ + Cu == 2Fe2+ + Cu2+;(1分)鐵粉或Fe(1分)
(2)
①25 mL。(2分)
②250mL容量瓶、膠頭滴管。(每空1分)
③錐形瓶內溶液顏色的變化,大于。(每空1分)
(3)MnO2+4HCI(濃) = MnCI2+CI2↑+2H2O(1分),MnO2(1分)
(4)抑制Fe3+(或FeCI3)的水解(2分)
(5)FeCI2或Fe2+(1分)
取少量溶液U,加入幾滴KSCN溶液,溶液顯紅色,則表明溶液U中有Fe3+(FeCI3);另取少量溶液U,加入幾滴酸性KMnO4溶液,若KMnO4溶液退色,則表明溶液U中有Fe2+(或FeCI2),說明通入的V的量不足夠若KMnO4溶液不退色,則說明通入的V的量 充足。(3分)
(6)4.0×10-11 mol·L-1(2分)


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
| 4.0×10-38 |
| (10-9)3 |
| 4.0×10-38 |
| (10-9)3 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| ||
| ||
查看答案和解析>>
科目:高中化學 來源:2012-2013學年江蘇省南通市海安縣高一上學期期末考試化學試卷(帶解析) 題型:實驗題
(12分)在FeCl3溶液蝕刻銅箔制造電路板的工藝中,廢液處理和資源回收的過程簡述如下:
I:向廢液中投入過量鐵屑,充分反應后分離出固體和濾液:
II:向濾液中加入一定量石灰水,調節溶液pH,同時鼓入足量的空氣。
試回答下列問題:
⑴FeCl3蝕刻銅箔反應生成FeCl2和CuCl2的離子方程式為 ;
證明蝕刻后的混合物溶液仍存在Fe3+的操作是:
。
⑵過程I加入鐵屑的主要作用是_______ ;從固體中分離出銅需采用的方法是_________ 。
⑶過程II中發生主要反應的化學方程式為:_____ , 。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪專題沖刺第9講 金屬及其化合物練習卷(解析版) 題型:填空題
在FeCl3溶液蝕刻銅箔制造電路板的工藝中,廢液處理和資源回收的過程簡述如下:
Ⅰ:向廢液中投入過量鐵屑,充分反應后分離出固體和濾液;
Ⅱ:向濾液中加入一定量石灰水,調節溶液pH,同時鼓入足量的空氣。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列問題:
(1)FeCl3蝕刻銅箔反應的離子方程式為________________________________________;
(2)過程Ⅰ加入鐵屑的主要作用是__________________,分離得到固體的主要成分是________,從固體中分離出銅需采用的方法是___________________________________;
(3)過程Ⅱ中發生反應的化學方程式為________________________________;
(4)過程Ⅱ中調節溶液的pH為5,金屬離子濃度為__________________________。(列式計算)
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省南通市海安縣高一上學期期末考試化學試卷(解析版) 題型:實驗題
(12分)在FeCl3溶液蝕刻銅箔制造電路板的工藝中,廢液處理和資源回收的過程簡述如下:
I:向廢液中投入過量鐵屑,充分反應后分離出固體和濾液:
II:向濾液中加入一定量石灰水,調節溶液pH,同時鼓入足量的空氣。
試回答下列問題:
⑴FeCl3蝕刻銅箔反應生成FeCl2和CuCl2的離子方程式為 ;
證明蝕刻后的混合物溶液仍存在Fe3+的操作是:
。
⑵過程I加入鐵屑的主要作用是_______ ;從固體中分離出銅需采用的方法是_________ 。
⑶過程II中發生主要反應的化學方程式為:_____ , 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com