
【題目】下表是元素周期表的一部分,回答下列有關問題:
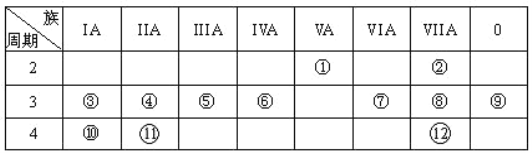
(1)寫出①原子結構示意圖_______________
(2)在這些元素中,金屬性最強的元素是_______,(填元素符號)元素⑦與元素⑧相比,非金屬性較強的是 _____________(填元素符號)
(3)⑤的最高價氧化物對應水化物與⑧的最高價氧化物對應水化物反應的離子方程式為:________________
(4)⑤的單質與③的最高價氧化物對應水化物反應的離子方程式為___________________________
(5)已知某元素原子最外層電子數是其次外層電子數的2倍,該元素可以與⑦形成一種AB2型的化合物,請用電子式表示其形成過程:_____________________________ 。
【答案】![]() K Cl Al(OH)3+3H+=Al3++3H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑
K Cl Al(OH)3+3H+=Al3++3H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ ![]()
【解析】
結合元素周期表的結構可知,①②③④⑤⑥⑦⑧⑨⑩分別為:N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br,據此解答。
(1)①為N,其原子結構示意圖為:![]() ,故答案為:
,故答案為:![]() ;
;
(2)根據同周期從左到右元素的金屬性逐漸減弱、非金屬性逐漸增強,同主族從上到下元素的金屬性逐漸增強、元素的非金屬性逐漸減弱,金屬性最強的為⑩K,元素⑦與元素⑧相比,非金屬性較強的是⑧(Cl),故答案為:K;Cl;
(3)⑤為Al,最高價氧化物對應水化物為Al(OH)3,⑧為Cl,其最高價氧化物對應水化物為HClO4,二者反應的離子方程式為:Al(OH)3+3H+=Al3++3H2O,故答案為:Al(OH)3+3H+=Al3++3H2O;
(4)⑤的單質即Al,③的最高價氧化物對應水化物即NaOH,Al和NaOH溶液反應的離子方程式為:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)原子最外層電子數是其次外層電子數的2倍,則該元素原子核外電子總數=2+4=6,該元素為C,與⑦形成AB2型化合物即CS2,用電子式表示CS2形成過程如下: ![]() →
→![]() ,故答案為:
,故答案為:![]() 。
。


 同步練習河南大學出版社系列答案
同步練習河南大學出版社系列答案 同步練習西南師范大學出版社系列答案
同步練習西南師范大學出版社系列答案 補充習題江蘇系列答案
補充習題江蘇系列答案 學練快車道口算心算速算天天練系列答案
學練快車道口算心算速算天天練系列答案科目:高中化學 來源: 題型:
【題目】化學興趣小組對某品牌牙膏中的摩擦劑成分及其含量進行以下探究:查得資料:該牙膏摩擦劑由碳酸鈣、氫氧化鋁組成;牙膏中其它成分遇到鹽酸時無氣體產生。
Ⅰ.摩擦劑中氫氧化鋁的定性檢驗
取適量牙膏樣品,加水充足攪拌、過濾。
(1)往濾渣中加入過量 NaOH溶液,過濾。氫氧化鋁與NaOH溶液反應的離子方程式是______。
(2)往(1)所得濾液中先通入過量二氧化碳,再加入過量稀鹽酸。觀察的現象是__________。
Ⅱ.牙膏樣品中碳酸鈣的定量測定
利用下圖所示裝置(圖中夾持儀器略去)進行實驗,充分反應后,測定C中生成的BaCO沉淀質量,以確定碳酸鈣的質量分數。
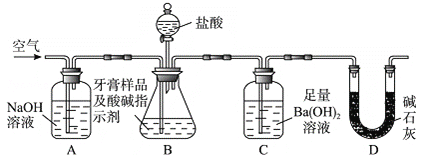
依據實驗過程回答下列問題:
(3)實驗過程中需持續緩緩通入空氣。其作用除了可攪拌B、C中的反應物外,還有:________________________________。
(4)C中反應生成沉淀的離子方程式是______________________________。
(5)下列各項措施中,不能提高測定準確度的是____________(填標號)。
a.在加入鹽酸之前,應排凈裝置內的CO2氣體 b.滴加鹽酸不宜過快
c.在A-B之間增添盛有濃硫酸的洗氣裝置
d.在B-C之間增添盛有飽和碳酸氫鈉溶液的洗氣裝置
(6)實驗中準確稱取10.00 g樣品三份,進行三次測定,測得BaCO3平均質量為3.94 g。則樣品中碳酸鈣的質量分數為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有反應:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃時,K=1,今在某密閉容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列說法不正確的是( )
CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃時,K=1,今在某密閉容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列說法不正確的是( )
A.900℃,該反應的平衡常數K<1
B.850℃達到平衡時,通入CO,CO轉化率將增大
C.850℃時,若x=5.0,則起始時平衡向逆反應方向移動
D.850℃時,若要使上述反應開始時向正反應方向進行,則![]() 應滿足0≤x<3
應滿足0≤x<3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以玉米(主要成分是淀粉)為原料制備乙醇的流程如下:

下列說法中不正確的是
A. C12H22O11屬于二糖
B. 1mol葡萄糖分解成3mol乙醇
C. 可用碘水檢驗淀粉是否完全水解
D. 可采取蒸餾的方法初步分離乙醇和水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電石法(乙炔法)制氯乙烯是最早完成工業化的生產氯乙烯的方法。
反應原理為HC≡CH+HCl![]() CH2=CHCl(HgCl2/活性炭作催化劑)。某學習小組的同學用下列裝置測定該反應中乙炔的轉化率(不考慮其他副反應)。鐵架臺及夾持儀器未畫出。(已知
CH2=CHCl(HgCl2/活性炭作催化劑)。某學習小組的同學用下列裝置測定該反應中乙炔的轉化率(不考慮其他副反應)。鐵架臺及夾持儀器未畫出。(已知![]() 的熔點為-159.8℃,沸點為-134℃。乙炔、氯乙烯、氯化氫均不溶于液體A)
的熔點為-159.8℃,沸點為-134℃。乙炔、氯乙烯、氯化氫均不溶于液體A)
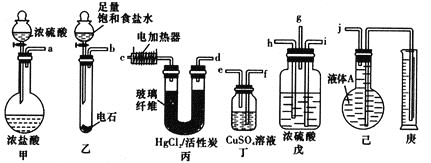
(1)各裝置的連接順序為(箭頭方向即為氣流方向):_________→________→_________→h→_________→______→_________→__________
(2)戊裝置除了均勻混合氣體之外,還有_________和_________的作用。
(3)乙裝置中發生反應的化學方程式為_________________________________。
(4)若實驗所用的電石中含有1.28gCaC2,甲裝置中產生0.02mol的HCl氣體。則所選用的量筒的容積較合理的是_______![]() 填字母代號
填字母代號![]() 。
。
A.500ml B.1000ml C.2000ml
(5)假定在標準狀況下測得庚中收集到的液體A的體積為672ml(導管內氣體體積忽略不計),則乙炔的轉化率為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組學生用![]() 的鹽酸與
的鹽酸與![]() 的NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量計算反應熱。下列說法錯誤的是
的NaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量計算反應熱。下列說法錯誤的是
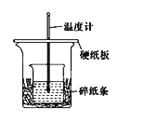
A.如圖條件下實驗過程中有熱量損失
B.圖中實驗裝置缺少環形玻璃攪拌棒
C.燒杯間填滿碎紙條的作用是固定小燒杯
D.若改用![]() 的NaOH溶液進行反應,所放出熱量相等
的NaOH溶液進行反應,所放出熱量相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉻酸鉛![]() 用作油性合成樹脂涂料、印刷油墨、水彩和油彩的顏料,色紙、橡膠和塑料制品的著色劑。
用作油性合成樹脂涂料、印刷油墨、水彩和油彩的顏料,色紙、橡膠和塑料制品的著色劑。
(1)![]() 中Cr的化合價為________________。
中Cr的化合價為________________。
(2)鉻酸鉛用于水彩和油彩的筑色顏料。遇到空氣中的硫化物顏色會變黑:![]() 的平衡常數
的平衡常數![]() ________________。
________________。![]()
(3)鉻渣![]() 鉻主要以
鉻主要以![]() 形式存在,同時含有
形式存在,同時含有![]() 、
、![]() 等雜質
等雜質![]() 是鉻電鍍過程中產生的含鉻污泥,實現其綜合利用,可減少鉻的環境污染。鉻渣綜合利用工藝流程如下:
是鉻電鍍過程中產生的含鉻污泥,實現其綜合利用,可減少鉻的環境污染。鉻渣綜合利用工藝流程如下:
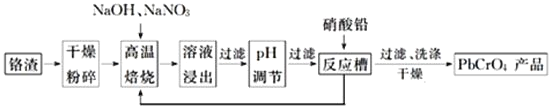
請回答下列問題:
![]() 鉻渣高溫焙燒前粉碎的目的是_____________________________。
鉻渣高溫焙燒前粉碎的目的是_____________________________。
![]() 高溫焙燒得到的產物含有
高溫焙燒得到的產物含有![]() 和一種無污染的氣體,則氧化劑和還原劑物質的量之比為________________。
和一種無污染的氣體,則氧化劑和還原劑物質的量之比為________________。
![]() 高溫焙燒時
高溫焙燒時![]() 參加反應的化學方程式為________________________。
參加反應的化學方程式為________________________。
![]() 除去浸出液中的雜質最好加入________
除去浸出液中的雜質最好加入________![]() 填試劑名稱
填試劑名稱![]() 來調節pH。除去鋁元素的離子方程式為___________________________________________。
來調節pH。除去鋁元素的離子方程式為___________________________________________。
![]() 現通過以上流程處理
現通過以上流程處理![]() 的鉻渣,得到
的鉻渣,得到![]() 產品
產品![]() ,則鉻渣中
,則鉻渣中![]() 的質量分數是________
的質量分數是________![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據報道,磷酸二氫鉀(KH2PO4)大晶體已應用于我國研制的巨型激光器“神光二號”中。利用氟磷灰石(化學式為Ca5P3FO12)制備磷酸二氫鉀的工藝流程如下圖所示(部分流程步驟已省略):
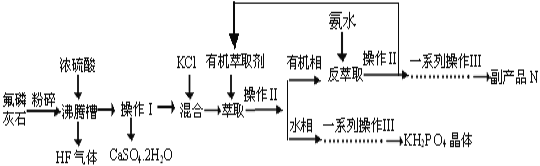
已知萃取的主要反應原理:KCl+H3PO4![]() KH2PO4+HCl;其中,反應產生的HCl易溶于有機萃取劑。
KH2PO4+HCl;其中,反應產生的HCl易溶于有機萃取劑。
請回答下列問題:
(1)流程中將氟磷灰石粉碎的目的是__________________________________。
(2)不能使用二氧化硅陶瓷材質的沸騰槽的主要原因是___________________(用化學方程式表示)。
(3)副產品N的化學式是____________;在得到KH2PO4晶體的一系列操作Ⅲ,其主要包括______________________________、過濾、洗滌、干燥等。
(4)若用1000kg質量分數為50.4%的氟磷灰石(化學式為Ca5P3FO12)來制取磷酸二氫鉀晶體,其產率為80%,則理論上可生產KH2PO4的質量為_______kg。
(5)電解法制備KH2PO4的裝置如圖所示.該電解裝置中,a 區屬于_______區(填“陽極”或“陰極”),陰極區的電極反應式是______________________________________。

(6)工業上還可以用氟磷灰石與焦炭、石英砂混合,在電爐中加熱到1500℃生成白磷,同時逸出SiF4和CO,該反應的化學方程式為________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的化合物應用廣泛,但氮氧化物是重要的空氣污染物,應降低其排放。
(1)用CO2和NH3可合成氮肥尿素
已知:①2NH3(g)+CO2(g)===NH2CO2NH4(s) △H=-159.5kJ·mol-1
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) △H=+116.5kJ·mol-1
③H2O(1)===H2O(g) △H=+44kJ·mol-1
用CO2和NH3合成尿素(副產物是液態水)的熱化學方程式為___________。
(2)工業上常用如下反應消除氮氧化物的污染:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H
N2(g)+CO2(g)+2H2O(g) △H
在溫度為T1和T2時,分別將0.40 mol CH4和1.0 mol NO2充入體積為1L的密閉容器中,n(CH4)隨反應時間的變化如圖所示:

①根據如圖判斷該反應的△H___________0(填“>”“<”或“=”),理由是___________。
②溫度為T1時,0~10min內NO2的平均反應速率v(NO)2=___________,反應的平衡常數K=______(保留三位小數)
③該反應達到平衡后,為再提高反應速率同時提高NO2的轉化率,可采取的措施有______(填編號)。
A.改用高效催化劑 B.升高溫度
C.縮小容器的體積 D.增加CH4的濃度
(3)利用原電池反應可實現NO2的無害化,總反應為6NO2+8NH3===7N2+12H2O,電解質溶液為NaOH溶液,工作一段時間后,該電池正極區附近溶液pH___________(填“增大”“減小”或“不變”),負極的電極反應式為___________。
(4)氮的一種氫化物HN3,其水溶液酸性與醋酸相似,則NaN3溶液中各離子濃度由大到小的順序為___________;常溫下將 a mol·L-1的HN3與b mol·L-1的Ba(OH)2溶液等體積混合,充分反應后,溶液中存在2c(Ba2+)=c(N3-),則該混合物溶液呈___________(填“酸”“堿”或“中”)性,溶液中c(HN3)=___________ mol·L-1。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com