
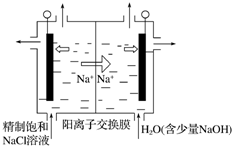
 二氧化氯(ClO2)為一種黃綠色氣體,是國際上公認的高效、廣譜、快速、安全的殺菌消毒劑.目前已開發出用電解法制取ClO2的新工藝.
二氧化氯(ClO2)為一種黃綠色氣體,是國際上公認的高效、廣譜、快速、安全的殺菌消毒劑.目前已開發出用電解法制取ClO2的新工藝.分析 ①由題意可知,氯離子放電生成ClO2,由元素守恒可知,有水參加反應,同時生成氫離子;
②在陰極發生2H++2e-=H2↑,通過陽離子交換膜的陽離子為+1價離子,根據n=$\frac{V}{{V}_{m}}$計算氫氣的物質的量,根據電子轉移守恒計算陽離子的物質的量;電解中H+濃度減小,使得H2O?OH-+H+的平衡向右移動.
解答 解:①由題意可知,氯離子放電生成ClO2,由元素守恒可知,有水參加反應,同時生成氫離子,電極反應式為:Cl--5e-+2H2O=ClO2↑+4H+,
故答案為:Cl--5e-+2H2O=ClO2↑+4H+;
②在陰極發生2H++2e-=H2↑,氫氣的物質的量為$\frac{0.112L}{22.4L/mol}$=0.005mol,通過陽離子交換膜的陽離子為+1價離子,故交換膜的陽離子的物質的量為0.005mol×2=0.01mol,電解中陰極H+濃度減小,使得H2O?OH-+H+的平衡向右移動,溶液的pH增大,
故答案為:0.01;增大.
點評 本題考查電解原理,為高頻考點,側重考查學生分析計算能力,明確各個物理量的關系及離子放電順序是解本題關鍵,生成氫氣與通過陽離子交換膜的陽離子的關系為易錯點,題目難度不大.


科目:高中化學 來源: 題型:解答題

 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
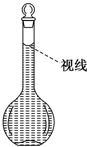 用18mol/L的濃硫酸配制80mL 1.0mol/L的稀硫酸,需用的實驗儀器有:A.100mL量筒 B.托盤天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.膠頭滴管 G.50mL燒杯 H.100mL容量瓶
用18mol/L的濃硫酸配制80mL 1.0mol/L的稀硫酸,需用的實驗儀器有:A.100mL量筒 B.托盤天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.膠頭滴管 G.50mL燒杯 H.100mL容量瓶查看答案和解析>>
科目:高中化學 來源: 題型:解答題
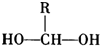 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$ 請根據圖作答:
請根據圖作答: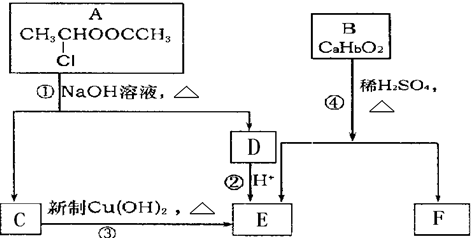

 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
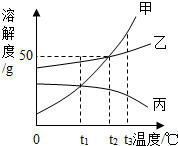
| A. | t1℃時,分別取出相同質量的甲、丙兩種飽和溶液升溫到t2℃時,甲和乙溶質的質量分數相等 | |
| B. | t2℃時,將甲、乙兩種飽和溶液分別恒溫蒸發等質量的水,析出晶體的質量可能不等 | |
| C. | 將三種飽和溶液分別從t3℃降低到t2℃時,甲和乙溶質的質量分數減小,丙的溶質的質量分數不變 | |
| D. | 當甲的飽和溶液中含有少量乙時,可以采取冷卻熱飽和溶液的辦法提取乙 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 反應結束時溶液的pH=7 | |
| B. | 反應后溶液中存在的粒子只有Na+和Cl- | |
| C. | 該反應的實質是H+和OH-結合生成水 | |
| D. | 反應前后所有元素的化合價均無變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
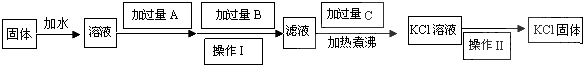
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 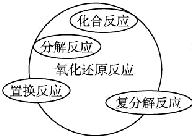 | B. | 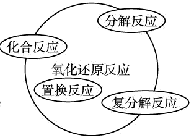 | ||
| C. |  | D. | 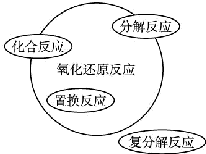 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com