
| A. | C、N、O三種元素第一電離能從大到小的順序是 O>N>C | |
| B. | 根據同周期元素的第一電離能變化趨勢,推出Al的第一電離能比Mg大 | |
| C. | 根據主族元素最高正化合價與族序數的關系,推出鹵族元素最高正價都是+7 | |
| D. | Ni原子的核外電子排布式為1s22s22p63s23p63d84s2 |
分析 A、同一周期元素,元素的第一電離能隨著原子序數增大而呈增大趨勢,但第IIA族、第VA族元素第一電離能大于其相鄰元素;
B、同一周期元素,元素第一電離能隨著原子序數增大而呈增大趨勢,但第IIA族和第VA族元素第一電離能大于其相鄰元素;
C、主族元素中,元素最高正化合價與其族序數相等,但O、F元素除外;
D、Ni是28號元素,其原子核外有28個電子.
解答 解:A、C、N、O元素處于同一周期,且原子序數依次增大,但N元素處于第VA族,所以第一電離能順序為N>O>C,故A錯誤;
B、同一周期元素,元素第一電離能隨著原子序數增大而呈增大趨勢,但第IIA族和第VA族元素第一電離能大于其相鄰元素,所以Mg元素第一電離能大于Al元素,故B錯誤;
C、主族元素中,元素最高正化合價與其族序數相等,但O、F元素除外,所以鹵族元素中除了F元素外其它元素最高正化合價為+7,故C錯誤;
D、Ni是28號元素,所以核外電子排布式為1s22s22p63s23p63d84s2,故D正確;
故選D.
點評 本題考查較綜合,涉及第一電離能大小判斷、元素化合價與族序數的關系等知識點,側重考查學生對物質結構和元素周期律等基本理論的考查,易錯選項是BC,要注意規律中的異常現象,題目難度不大.


科目:高中化學 來源: 題型:多選題
| A. | 自然界中有11H、12H、13H三種氫的同位素,它們的化學性質不相同 | |
| B. | ${\;}_{1}^{1}$H失去1個電子后,變成1個質子 | |
| C. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是三種不同的原子 | |
| D. | 11H、21H、31H在化學反應中容易失去一個電子而顯+1價 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯與氯氣加成(1,2-二氯乙烷) | |
| B. | 等物質的量的氯氣與乙烷在光照下反應(氯乙烷) | |
| C. | 乙烯與水加成(乙醇) | |
| D. | 乙烯與氯化氫在一定條件下反應(氯乙烯) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,工業合成路線如下:
,工業合成路線如下:

 (R-代表烴基)
(R-代表烴基) 、
、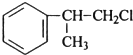 ;
;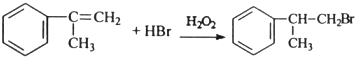 ;
; .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ni2+:[Ar]3d8 | B. | Cu:[Ar]3d94s2 | C. | S2-:[Ne]2s23p6 | D. | Si:[Ar]3s23p2 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 容器 編號 | 溫度/℃ | 起始物質的量/mol | 平衡物質的量/mol | |
| CO | H2 | CH3OH(g) | ||
| Ⅰ | T1 | 0.2 | 0.4 | 0.18 |
| Ⅱ | T1 | 0.4 | 0.8 | |
| Ⅲ | T2 | 0.2 | 0.4 | 0.16 |
| A. | 該反應的正反應為放熱反應 | |
| B. | 達平衡時,容器Ⅰ中CH3OH(g)的體積分數比容器Ⅱ中的大 | |
| C. | 采取加壓、增大c(H2)、加入合適的催化劑等措施,都能提高CO的轉化率 | |
| D. | 若起始時向容器Ⅰ中充入CO 0.2 mol、H2 0.2 mol、CH3OH(g)0.5 mol,則反應將向正反應方向進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ;C 單質在高溫下與B單質充分反應所得化合物的電子式為
;C 單質在高溫下與B單質充分反應所得化合物的電子式為
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com