
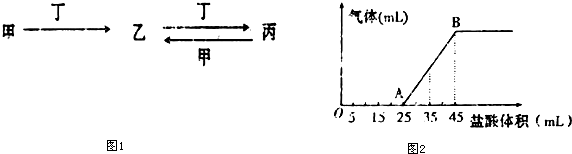
分析 若甲為氯堿工業的產品,含丙的某種藥品可用于治療胃酸過多,則丙為碳酸氫鈉,根據題中各物質轉化關系可知,甲為氫氧化鈉,丁為二氧化碳,乙為碳酸鈉,據此答題.
解答 解:若甲為氯堿工業的產品,含丙的某種藥品可用于治療胃酸過多,則丙為碳酸氫鈉,根據題中各物質轉化關系可知,甲為氫氧化鈉,丁為二氧化碳,乙為碳酸鈉,
①等濃度的碳酸鈉溶液和碳酸氫鈉溶液,a.與NaOH溶液均無明顯現象;b.與CaC12溶液碳酸鈉溶液有沉淀而碳酸氫鈉沒有;c.與稀硫酸反應產生氣體的速率碳酸氫鈉快于碳酸鈉;d.與澄清石灰水均有沉淀生成,所以鑒別等濃度的碳酸鈉溶液和碳酸氫鈉溶液,可選用bc,
故答案為:bc;
②將甲、乙、丙三種溶液混合,其中碳酸氫鈉會與氫氧化鈉反應,所以所得溶液可以是碳酸鈉與碳酸氫鈉的混合物也可能是碳酸鈉與氫氧鈉的混合物,或純碳酸鈉溶液,根據向混合液中逐滴加入一定濃度的鹽酸,生成氣體的體積(標準狀況)與加入鹽酸的體積關系圖可知,產生氣體用去的鹽酸體積小于不產生氣體用去鹽酸的體積,所以可推知混合溶液為碳酸鈉與氫氧鈉的混合物,OA段為鹽酸先與氫氧化鈉反應再與碳酸鈉反應生成碳酸氫鈉,反應的離子方程式為OH-+H+=H2O、CO32-+H+=HCO3-,AB段為碳酸氫鈉與鹽酸產生二氧化碳,反應的離子方程式為HCO3-+H+=CO2+H2O,當產生氣體的體積為224mL時,氣體物質的量=$\frac{0.224L}{22.4L/mol}$=0.01mol,用去鹽酸的物質的量為0.01mol,根據圖象可知此時產生氣體用去的鹽酸的體積為35mL-25mL=10mL,所以鹽酸的濃度為$\frac{0.01mol}{0.01L}$=1mol/L,
故答案為:OH-+H+=H2O、CO32-+H+=HCO3-;1mol/L.
點評 本題考查無機物的推斷,為高頻考點,綜合考查元素化合物知識,把握物質的性質、發生的轉化反應為解答的關鍵,側重分析與推斷能力的考查,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 18O存在于乙酸、乙酸乙酯和水中 | B. | 18O只存在于乙醇中 | ||
| C. | 18O只存在于乙酸和水中 | D. | 18O存在于水中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗內容 | 實驗目的 | |
| A | 向碳酸鈉溶液中滴入幾滴酚酞溶液 | 證明碳酸鈉溶液呈堿性 |
| B | 取少量未知溶液于一只干凈的試管中,向該溶液中逐漸滴入NaOH溶液直至過量 | 檢驗該溶液中是否含有Al3+ |
| C | 取未知溶液做焰色反應實驗,并通過藍色鈷玻璃觀看 | 檢驗該溶液中是否含有K+ |
| D | 取少量未知溶液,滴加新制的氯水,再滴加KSCN溶液 | 檢驗未知液中是否含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲烷與氯氣發生取代反應 | B. | 乙烯與溴水發生加成反應 | ||
| C. | 氯氣與氫氣反應生成氯化氫 | D. | 乙醇與乙酸的酯化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若8>m>3,則X必定為主族元素 | |
| B. | 若a<b<m=n=4,則晶體類型相同時,其單質熔點:X>Y | |
| C. | 若Y的氣態氫化物化學式為YHn,且b<4,則該氫化物為非極性分子 | |
| D. | 若a=b=3,8>m>n>b,則元素非金屬性:X>Y |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③④⑤⑥ | B. | ①③④⑤ | C. | ①②③④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑大小順序:C>D>B>A | |
| B. | 由B和C元素組成的化合物,可以既含有離子鍵,又含共價鍵 | |
| C. | 元素B、D、E分別與A形成的化合物中,熔沸點最高的是B與A形成的化合物 | |
| D. | 元素D與C形成的化合物在空氣中長期放置不易變質 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com