
【題目】現有下列10種物質①熔融的氫氧化鈉②蔗糖③純凈的鹽酸④金屬鈉⑤硫酸⑥二氧化硫⑦硫粉⑧偏鋁酸鈉溶液⑨酒精溶液⑩液氨(注意:下面前三問的答案請填序號!)
(1)屬于電解質的有__。
(2)屬于非電解質的有__。
(3)上述狀態下的電解質能導電的有__。
(4)偏鋁酸鈉溶液中通足量二氧化碳反應的離子方程式:__。
科目:高中化學 來源: 題型:
【題目】利用有機物X在一定條件下可合成植物生長所需的“平衡因子”Y(部分產物未寫出)。已知含有“手性碳原子”的分子可形成對映異構體。下列有關說法中正確的是( )
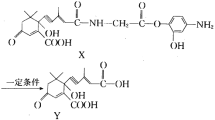
A.X,Y分子都不存在對映異構體
B.X分子中所有碳原子可能都在同一平面
C.Y分子可以發生取代、酯化、消去、加成、氧化等反應
D.未寫出的產物可能有2種,且都具有兩性化合物的特性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.碳元素廣泛存在于自然界中,對人類生命和生活具有重要意義。含碳化合物在工業生產和國防建設中有廣泛的應用。
(1)碳元素原子核外有_____個未成對電子,最外層有_____種能量不同的電子。CH4 分子的空間構型為_____,是_____分子。(填“極性”或“非極性”)
(2)碳和硅是同主族元素,下列能說明二者非金屬性相對強弱的是_____(填編號)
a.CH4的穩定性比SiH4強 b.SiH4的沸點比CH4高
c.碳酸是強酸,硅酸是弱酸 d.碳原子半徑比硅原子小
II.氮化硅(Si3N4)是一種重要的陶瓷材料,可用石英與焦炭在800℃氮氣氣氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)該反應的平衡常數表達式K_____。已知平衡常數:K(800℃)>K(850℃),則正反應是__________反應(填“放熱”或“吸熱”)
(2)任寫兩種能提高二氧化硅轉化率的措施_____、_____。
(3)一定溫度下,在2 L密閉容器內,充入一定量的反應物,5分鐘時達到平衡,測得容器內氣體增加了0.4mol,用CO表示該反應時間內的反應速率為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 熱化學方程式中,化學式前面的化學計量數既可表示微粒數,又可表示物質的量
B. 書寫熱化學方程式時,不僅要寫明反應熱的符號和數值,還要注明各物質的聚集狀態
C. 熱化學方程式中,如果沒有注明溫度和壓強,則表示在標準狀況下測得的數據
D. 凡是化合反應都是放熱反應,分解反應都是吸熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】釩和鈦金屬的性能都很優越,在航空航天領域用途廣泛。回答下列問題:
(1)鈦元素基態原子的電子排布式為______________,未成對電子數為_______________個。
(2)[TiO(H2O2)2]2+配離子呈黃色。提供中心原子孤電子對的成鍵原子是_____________(填元素符號),中心原子的化合價為_____________;配體之一H2O2中氧原子雜化類型為__________,H2O2分子中氧原子的價層電子對互斥模型是______________。
(3)單質釩及鈦都是由______________鍵形成的晶體,己知金屬鈦是六方最密堆積,金屬釩是體心立方堆積,則__________(填“鈦”,或“釩”)的空間利用率較大。
(4)碳化釩主要用于制造釩鋼及碳化物硬質合金添加劑,其晶胞結構如圖所示。
 (小球為V原子)
(小球為V原子)
①晶胞中碳原子與釩原子的數量比為____________。
②該晶胞中與碳原子距離最近且相等的碳原子個數為_____________。
③若合金的密度為dg· cm-3,晶胞參數α=______nm。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據合成氨反應的能量變化示意圖,下列有關說法正確的是( )
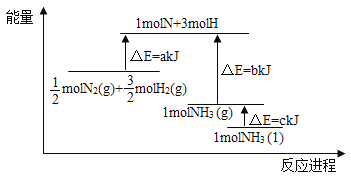
A. 若合成氨反應使用催化劑,反應放出的熱量增多
B. 斷裂0.5moIN2(g)和1.5molH2(g)中所有的化學鍵釋放akJ熱量
C. 2NH3(l)= N2(g)+3H2(g) △H=2(b+c-a) kJ/mol
D. N2(g)+3H2(g)=2NH3(g) △H=-2(a-b)kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中進行可逆反應,A與B反應生成C,其反應速率分別用υ(A)、υ(B)、υ(C)(molL﹣1s﹣1)表示,且υ(A)、υ(B)、υ(C)之間有如下所示的關系:υ(B)=3υ(A); 3υ(C)=2υ(B)。則此反應可表示為( )
A. 2A+3B![]() 2CB. A+3B
2CB. A+3B![]() 2C
2C
C. 3A+B![]() 2CD. A+B
2CD. A+B![]() C
C
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵粉具有平肝鎮心,消癰解毒之功效,主治驚癇、癲狂、腳氣沖心、貧血等。某興趣小組探究用氫氣和碳酸亞鐵制取鐵粉并檢驗反應產物,實驗裝置如圖。下列說法不正確的是
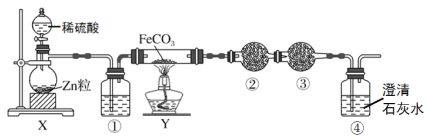
A.通過調節分液漏斗的活塞以控制①中氣泡產生快慢
B.裝置①的作用是干燥氫氣
C.裝置②、③中的藥品分別是無水硫酸銅、堿石灰
D.加熱裝置Y前,應先讓X反應一段時間,排除裝置中的空氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業合成氨緩解了有限耕地與不斷增長的人口對糧食大量需求之間的矛盾。
(1)N2分子通常條件下非常穩定,其本質原因是_____,工業上選擇500℃主要出于兩方面考慮,一是反應速率快;二是_____。
(2)將1mol氣態分子斷裂成氣態原子所吸收的能量叫鍵能。相關鍵能數據如下表:
共價鍵 | H-H | N≡N | N-H |
鍵能(kJ/mol) | 436 | 946 | 391 |
結合表中所給信息,下圖中能正確表示合成氨反應過程中能量變化關系的是_____。
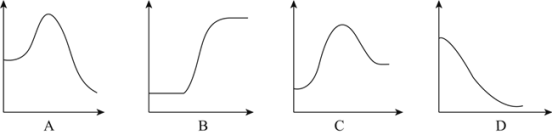
(3)一定條件下,氨與水的反應存在限度,氨水成弱堿性,用一個化學用語,表示氨與水反應及溶液顯堿性的原因_____。
(4)硫酸銨是一種固態氮肥,俗稱“肥田粉”。硫酸銨可由氨與硫酸反應生成,硫酸銨中含有的化學鍵類型有_____。
(5)氨氧化法可以用來生產硝酸,寫出第一步和第三步的化學反應方程式_________________、_________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com