
 CH3OH(g) ΔH
CH3OH(g) ΔH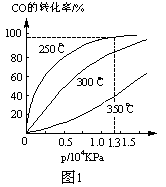
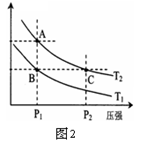
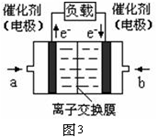


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:不詳 題型:單選題
| A.①④ | B.①②④ | C.①②④⑤ | D.①②③④ |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2NH3(g) △H="-92" kJ/mol。為提高氫氣的轉化率,宜采取的措施有 。(填字母)
2NH3(g) △H="-92" kJ/mol。為提高氫氣的轉化率,宜采取的措施有 。(填字母)| A.升高溫度 | B.使用催化劑 |
| C.及時移出氨 | D.循環利用和不斷補充氮氣 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
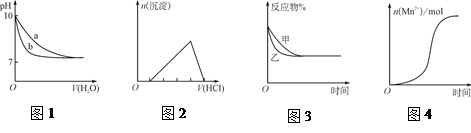
| A.圖1表示相同溫度下,向pH=10的氫氧化鈉溶液和氨水中分別加水稀釋時pH的變化曲線,其中a表示氨水稀釋時pH的變化曲線 |
| B.圖2表示向含有少量氫氧化鈉的偏鋁酸鈉溶液中滴加鹽酸所得沉淀物質的量與鹽酸體積的關系 |
C.圖3表示壓強對可逆反應CO(g)+H2O(g)  CO2(g)+H2(g)的影響,乙的壓強比甲的壓強大 CO2(g)+H2(g)的影響,乙的壓強比甲的壓強大 |
| D.圖4表示10 mL 0.01 mol·L-1KMnO4酸性溶液與過量的0.1 mol·L-1 H2C2O4溶液混合時,n(Mn2+)隨時間的變化(Mn2+對該反應有催化作用) |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

 Si(s)+3HCl(g)不同溫度及不同n(H2)/n(SiHCl3)時,反應物X的平衡轉化率關系如圖;
Si(s)+3HCl(g)不同溫度及不同n(H2)/n(SiHCl3)時,反應物X的平衡轉化率關系如圖;

查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
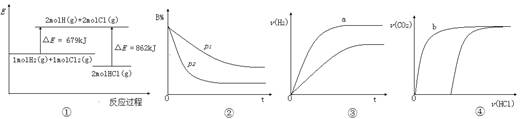
| A.①表示反應H2(g)+Cl2(g)=2HCl(g)的能量變化,則該反應的△H="183" kJ·mol-1 |
B.②表示其它條件不變時,反應4A(g)+3B(g) 2C(g)+6D在不同壓強下B%(B的體積分數)隨時間的變化,則D一定是氣體 2C(g)+6D在不同壓強下B%(B的體積分數)隨時間的變化,則D一定是氣體 |
| C.③表示體積和pH均相同的HCl、CH3COOH兩種溶液中,分別加入足量的鋅,產生H2的體積隨時間的變化,則a表示的是HCl溶液 |
| D.④表示10 mL 0.1 mol·L-1 Na2CO3和NaHCO3兩種溶液中,分別滴加0.l mol/L HCl溶液時,CO2的體積隨鹽酸體積的變化,則b表示的是NaHCO3溶液 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| 物質 n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com