
| A.化學反應速率 | B.化學反應的平衡常數(shù) |
| C.水的離子積 | D.吸熱反應反應物的轉化率 |
科目:高中化學 來源:不詳 題型:問答題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.用反應熱數(shù)據的大小判斷不同反應反應速率的快慢 |
| B.用pH數(shù)據推測相同濃度的不同強酸弱堿鹽在水溶液中水解程度的大小 |
| C.應用蓋斯定律,可計算某些難以直接測量的反應焓變 |
| D.用平衡常數(shù)的大小判斷化學反應可能進行的程度 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 CH3OH(g) ΔH
CH3OH(g) ΔH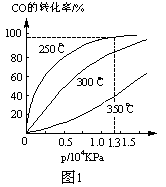
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
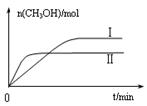
 CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H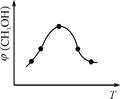
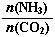 =3,達平衡時CO2的轉化率為60%,則NH3的平衡轉化率為
=3,達平衡時CO2的轉化率為60%,則NH3的平衡轉化率為查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

 HOCH2-CH2OH(g)+2CH3OH(g) △H =" -34" kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H =" -34" kJ/mol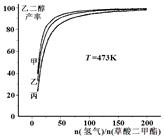
 H++OH-、HC2O4-
H++OH-、HC2O4- H++C2O42-和 。
H++C2O42-和 。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
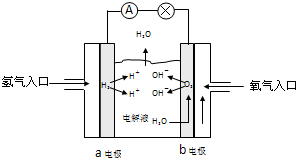
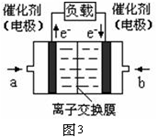
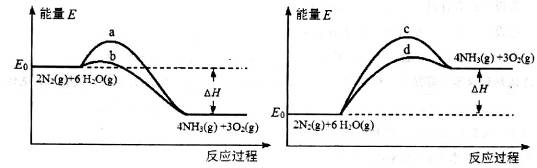
 2NH3(g),則在電解法合成氨的過程中,應將H2不斷地通入_________極(填“陰”或“陽”) ;向另一電極通入N2,該電極的反應式為__________________________。
2NH3(g),則在電解法合成氨的過程中,應將H2不斷地通入_________極(填“陰”或“陽”) ;向另一電極通入N2,該電極的反應式為__________________________。 4NH3(g)+3O2(g) △H=Q。
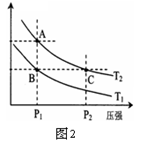
4NH3(g)+3O2(g) △H=Q。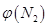 與反應溫度T的關系曲線如圖所示,則上述反應的Q________0(填“>”、“<”或“=”)。
與反應溫度T的關系曲線如圖所示,則上述反應的Q________0(填“>”、“<”或“=”)。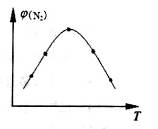
 2NH3(g) △H=-93.0kJ/mol。
2NH3(g) △H=-93.0kJ/mol。查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.鉛蓄電池在放電過程中,正負極質量均增加 |
| B.常溫下,反應C(s)+CO2(g)=2CO(g)不能自發(fā)進行,則該反應的△H> O |
| C.25℃時,Mg(OH)2固體在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
D.將濃度為0.1mol·L-1的HF溶液加水不斷稀釋,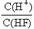 的值始終保持增大 的值始終保持增大 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
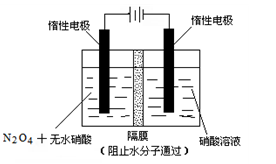
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com