
實驗室欲用已配好的質量分數為10%的氫氧化鈉溶液(密度為1.1g/cm3),配制100g質量分數為5%的氫氧化鈉溶液,并用此溶液測定某硫酸溶液的溶質質量分數。
(1)配制100g質量分數為5%的氫氧化鈉溶液,需要10%的氫氧化鈉溶液 g。
(2)配制氫氧化鈉溶液時,需要的玻璃儀器有 、滴管、燒杯、玻璃棒。
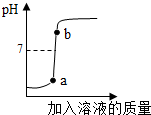
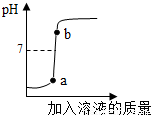
(3)用配得的氫氧化鈉溶液與待測溶質質量分數的硫酸溶液反應,實驗過程中溶液的pH變化曲線如圖所示:
①根據如圖變化曲線,判斷進行的操作是 (填字母)。
A.將硫酸溶液逐滴滴加到氫氧化鈉溶液中
B.將氫氧化鈉溶液逐滴滴加到硫酸溶液中
②b點對應的溶液中的溶質為 (寫化學式)。
(4)若完全中和50g稀硫酸溶液,恰好消耗配得的氫氧化鈉溶液80g,試計算該稀硫酸的溶質質量分數(請寫出計算過程)
(1)50;(2)量筒;(3)①B;②Na2SO4、NaOH;(4)9.8%
【解析】
試題分析:(1)根據稀釋前后溶質不變考慮。設需要10%的氫氧化鈉溶液質量為X則:100g×5%=X×10%解得X=50g;
(2)量取水時需要的玻璃儀器有量筒、膠頭滴管,溶解時需要的玻璃儀器有燒杯、玻璃棒,因此缺少玻璃儀器是量筒;
(3)①曲線所示,反應后溶液的酸堿度逐漸增大,說明此實驗是把氫氧化鈉溶液逐滴加入硫酸溶液中,而使溶液的酸堿度逐漸增大;故為B;
②b點溶液酸堿度大于7,說明滴加的氫氧化鈉過量,因此溶液為硫酸鈉與氫氧化鈉的混合溶液,其溶質為Na2SO4 、NaOH;
(4)根據反應的化學方程式,由恰好完全反應消耗氫氧化鈉的質量,計算所消耗50g硫酸溶液中硫酸的質量,求得該硫酸溶液中溶質的質量分數。設該稀硫酸中溶質的質量為x
2NaOH+H2SO4 =Na2SO4 +2H2O
80 98
80g×5% X
根據: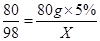
解得X=4.9g
該稀硫酸的溶質質量分數為: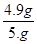 ×100%=9.8%
×100%=9.8%
答:待測硫酸的質量分數為9.8%
考點:考查中和反應及其應用;有關溶質質量分數的簡單計算;根據化學反應方程式的計算


 優翼小幫手同步口算系列答案
優翼小幫手同步口算系列答案科目:初中化學 來源: 題型:
 (2013?塘沽區二模)某化學學習小組同學在實驗室中練習配制一定溶質質量分數的溶液.
(2013?塘沽區二模)某化學學習小組同學在實驗室中練習配制一定溶質質量分數的溶液.查看答案和解析>>
科目:初中化學 來源: 題型:
 (2013?雨花臺區一模)實驗室欲用已配好的質量分數為10%的氫氧化鈉溶液(密度為1.1g/cm3),配制100g質量分數為5%的氫氧化鈉溶液,并用此溶液測定某硫酸溶液的溶質質量分數.
(2013?雨花臺區一模)實驗室欲用已配好的質量分數為10%的氫氧化鈉溶液(密度為1.1g/cm3),配制100g質量分數為5%的氫氧化鈉溶液,并用此溶液測定某硫酸溶液的溶質質量分數.| 80 |
| 98 |
| 80g×5% |
| X |
| 4.9g |
| 50g |
| 80 |
| 98 |
| 80g×5% |
| X |
| 4.9g |
| 50g |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 某化學學習小組同學在實驗室中練習配制一定溶質質量分數的溶液.
某化學學習小組同學在實驗室中練習配制一定溶質質量分數的溶液.查看答案和解析>>
科目:初中化學 來源:2013年江蘇省南京市雨花臺區中考化學一模試卷(解析版) 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com