人們發現,用氯化鈀(PdCl2)溶液可檢驗CO對大氣污染情況.CO和PbCl2溶液反應(水參加反應)生成黑色金屬鈀粉末、二氧化碳和氯化氫,反應的化學方程式為:PdCl2+H2O+CO=Pd↓+CO2+2HCl.現將50L空氣(密度為1.29g/L)通過足量的PbCl2溶液,將過濾得到的固體干燥,稱其質量為0.106g,求所測定空氣中一氧化碳的質量分數是多少?
【答案】
分析:根據反應的化學方程式,可確定反應中鈀與一氧化碳的質量關系,利用這一質量關系,由反應后得到Pd的質量可計算反應消耗一氧化碳的質量.
解答:解:設空氣中CO的質量為x
PdCl
2+H
2O+CO=CO
2↑+2HCl+Pd
28 106
x 0.106g
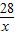
=

,
解得,x=0.028g
空氣中CO的質量分數為:

×100%=0.043%.
答:所測定空氣中一氧化碳的質量分數是0.043%.
點評:本題為根據化學方程式的基礎計算,完整的計算過程、規范的書寫格式、正確的計算結果是解答此類問題時需要認真對待的.
