
【題目】氧氣、二氧化碳是我們身邊常見的物質。某興趣小組對這兩種氣體研究如下:
Ⅰ.氧氣、二氧化碳的制備:
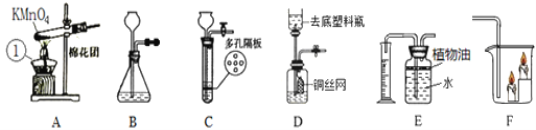
(1)寫出A圖中有標號儀器①的名稱:__________。
(2)寫出用KMnO4制取O2的化學方程式___________________,該裝置中棉花團的作用是__________,圖中裝置一處明顯的錯誤是__________。
(3)在化學實驗室中用石灰石和稀鹽酸來制取二氧化碳可選用圖B所示的發生裝置,該反應的化學方程式是__________。
(4)制二氧化碳也可選用如圖C所示的裝置,與B裝置相比,C裝置的優點是_________,用圖D裝置也可以制取二氧化碳,將石灰石放在銅絲網中,該實驗說明了銅____(填“能”或“不能”)和稀鹽酸發生反應。
Ⅱ.二氧化碳的性質及氧氣的收集研究:
(1)二氧化碳的性質研究
①如圖E所示的裝置可以測定一段時間收集的二氧化碳的體積,植物油的作用是____。
②如圖F所示的裝置說明了二氧化碳具有__________的性質,該性質在實際生活中的應用是__________。
③已知:CO2和SO2既有相似性,又有差異性。
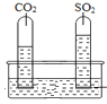
實驗一:將收集滿兩種氣體的試管同時倒立于盛水的水槽中,片刻后實驗現象如圖所示,說明相同條件下SO2比CO2__________(填“易”或“難”)溶于水。
實驗二:已知鎂條可以在CO2中劇列燃燒: 2Mg+CO2![]() 2MgO+C,試推測鎂條在SO2中燃燒的現象為:劇烈燃燒,__________。
2MgO+C,試推測鎂條在SO2中燃燒的現象為:劇烈燃燒,__________。
(2)氧氣的收集
(實驗1)用向上排空氣法收集氧氣,當放置在集氣瓶口帶火星木條復燃時停止收集,測定瓶中氧氣的含量,重復實驗3次。
(實驗2)用向上排空氣法收集氧氣,當放置在集氣瓶口帶火星木條復燃后,繼續收集40秒,測定瓶中氧氣的含量,重復實驗3次。
(實驗3)用排水法收集氧氣,測定瓶中氧氣的含量,重復實驗3次。
實驗數據:
實驗1 | 實驗2 | 實驗3 | |||||||
氧氣的體積分數(%) | 79.7 | 79.6 | 79.9 | 88.4 | 89.0 | 87.9 | 90.0 | 89.8 | 89.3 |
氧氣的平均體積分數(%) | 79.7 | 88.4 | 89.7 | ||||||
數據①由實驗1、2可知,用向上排空氣法收集氧氣時,為提高獲得的氧氣體積分數,可采取的措施是__________。
②不考慮操作因素,實驗3獲得的氧氣體積分數不能達到100%的主要原因是_________。
【答案】酒精燈 2KMnO4 ![]() K2MnO4 + MnO2 + O2 ↑ 防止高錳酸鉀進入導管 試管口向上傾斜 CaCO3 + 2HCl ==== CaCl2 + H2O +CO2 ↑ 控制反應的發生和停止 不能 防止二氧化碳溶于水,并與水反應 密度比空氣大,不能燃燒也不支持燃燒 滅火等 易 生成白色固體和黃色固體,放熱 驗滿后繼續收集一段時間(合理即可) 氣體中含有較多水蒸氣(合理即可)
K2MnO4 + MnO2 + O2 ↑ 防止高錳酸鉀進入導管 試管口向上傾斜 CaCO3 + 2HCl ==== CaCl2 + H2O +CO2 ↑ 控制反應的發生和停止 不能 防止二氧化碳溶于水,并與水反應 密度比空氣大,不能燃燒也不支持燃燒 滅火等 易 生成白色固體和黃色固體,放熱 驗滿后繼續收集一段時間(合理即可) 氣體中含有較多水蒸氣(合理即可)
【解析】
Ⅰ.(1)①是酒精燈。
(2)KMnO4在加熱條件下發生反應生成錳酸鉀、二氧化錳、氧氣。該裝置中棉花團的作用是防止高錳酸鉀進入導管,給固體加熱時,試管口要略向下傾斜。
(3)實驗室中用石灰石和稀鹽酸來制取二氧化碳,石灰石主要成分是碳酸鈣,與稀鹽酸反應生成氯化鈣、水、二氧化碳。
(4)關閉C裝置的止水夾,氣體不能排出,試管內壓強變大,稀鹽酸被壓進長頸漏斗中,與石灰石分離,反應停止,打開止水夾,稀鹽酸從長頸漏斗中流出,液面上升,稀鹽酸與石灰石接觸,反應發生,所以C裝置的優點是能隨時控制反應的發生和停止。D裝置中的銅絲網與稀鹽酸接觸,實驗說明了銅不能和稀鹽酸發生反應。
Ⅱ.(1)①二氧化碳易溶于水,并能與水反應,裝置E中植物油的作用是防止二氧化碳溶于水、與水反應。②裝置F中的下層蠟燭先熄滅,上層蠟燭后熄滅,說明二氧化碳先占據下方空間,即二氧化碳的密度比空氣的密度大,還說明二氧化碳不能燃燒也不支持燃燒,在實際生活中利用該性質滅火。③將收集滿兩種氣體的試管同時倒立于盛水的水槽中,片刻后盛二氧化硫的試管中進入的水多,說明相同條件下SO2比CO易溶于水。鎂條可以在CO2中劇列燃燒:2Mg+CO2![]() 2MgO+C,可推測鎂條在SO2中燃燒生成氧化鎂和硫,氧化鎂是白色固體,硫是黃色固體,可推測實驗現象是劇列燃燒、生成白色固體和黃色固體,放熱。
2MgO+C,可推測鎂條在SO2中燃燒生成氧化鎂和硫,氧化鎂是白色固體,硫是黃色固體,可推測實驗現象是劇列燃燒、生成白色固體和黃色固體,放熱。
(2)①由實驗數據可知,當放置在集氣瓶口帶火星木條復燃后,繼續收集40秒,瓶中氧氣的含量高,所以用向上排空氣法收集氧氣時,為提高獲得的氧氣體積分數,可采取的措施是驗滿后繼續收集一段時間。②用排水法獲得的氧氣體積分數不能達到100%的主要原因是氣體中含有較多水蒸氣。


 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:
【題目】閱讀下面科普短文。
“瘋狂”的星球

金星是太陽系中八大行星之一,中國古代稱之為長庚、啟明、太白金星。金星地表大氣壓約是地球的90倍,大氣成分主要由二氧化碳組成,約占96%,因此它的地表具有強烈的溫室效應,在近赤道的低地,溫度可高達500°C。
在高度50至70公里的金星上空,懸浮著濃密的厚云,把大氣分割為上下兩層。你知道嗎?地球云層的主要成分是水(水的液滴),而金星云層的主要成分是硫酸(硫酸的液滴),其中還摻雜著硫的粒子,所以呈現黃色。H2SO4的生成主要源于太陽光中波長短于160nm的紫外光對CO2的光解,使其變為CO和原子氧,原子氧非常活潑,能與SO2反應變為SO3,SO3與水反應變為H2SO4,在金星,下的雨真是名副其實的酸雨。金星里,H2SO4的形成過程是不斷循環的,H2SO4從大氣較高較冷的區域降至較低較熱的區域,當溫度達到300℃時,H2SO4開始分解為SO3和水,SO3再分解為SO2和原子氧,原子氧接著與CO反應變為CO2。SO2與水會上升到上層,重新反應又釋放出H2SO4。
依據文章內容,回答下列問題。
(1)金星地表具有強烈的溫室效應是因為____________。
(2)原子氧的符號為____________。
(3)硫酸分解反應的化學方程式為____________。
(4)在硫酸循環的過程中,下列說法正確的是____________(填字母序號)。
A. CO2光解變為CO和原子氧的變化為化學變化
B. SO3與水反應變為H2SO4為化合反應
C. CO變為CO2的過程中原子氧是催化劑
(5)金星被稱為“瘋狂”星球的原因是____________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】2018年1月,廈門地鐵Ⅰ號線正式開通。地鐵Ⅱ號線、Ⅲ號線、Ⅳ號線也將陸續開通。愛萌同學采用“地鐵線路圖”的形式,將不同物質的轉化關系表示如下圖(圈中“→”表示物質的轉化關系)。
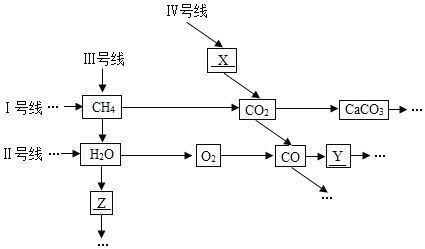
(1)在圖中已知的6種物質中,屬于單質的是_______,可作燃料的是_______。
(2)通過CH4或CO2的轉化可以完成“Ⅰ號線到 Ⅱ號線的換乘”,請任選一轉化完成“換乘”,寫出反應的化學方程式為________________。
(3)已知“H2O→Z”發生分解反應,X含有兩種且其中一種與Z相同,則X的化學式為_______;若Y是一種紫紅色金屬,寫出上述轉化中生成Y的化學方程式為______________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在一密閉容器中,物質X不完全燃燒時可以產生一氧化碳、二氧化碳和水。依據下表數據分析得出的結論中,正確的是
物質 | X | 氧氣 | 二氧化碳 | 水 | 一氧化碳 |
反應前質量/g | 6.6 | 8.8 | 0 | 0 | 0 |
反應后質量/g | 2 | 0 | 6.6 | 5.4 | a |
A. X中碳元素的質量分數為52.2% B. X中只含有C、H兩種元素
C. 表中a的值為3.4 D. 無法確定X中是否含有氧元素
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如圖是A、B、C三種物質的溶解度曲線圖,下列說法一定正確的是
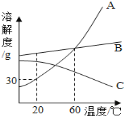
A. 將三種物質的飽和溶液分別由60℃降溫到20℃,A溶液中析出的晶體質量最大
B. C可能是氫氧化鈣溶液
C. 采用蒸發結晶的方法除去A溶液中混有的少量B
D. 60℃時,等質量的A、C飽和溶液中,水的質量是A<C
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】水是生命之源,人類的生產、生活都離不開水。
(1)自然界中的水含有許多可溶性和不溶性雜質。長期飲用硬水可能會引起體內結石,生活中常用____________的方法來降低水的硬度。
(2)水是常用的溶劑,配制下列溶液時,以水做溶劑的是_______(填序號)。
A.生理鹽水 B.醫用碘酒 C.高錳酸鉀溶液 D.醫用酒精
(3)下表是NaCl、KNO3在不同溫度時的溶解度
溫度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
①根據表中的數據,在坐標紙上繪制出氯化鈉和硝酸鉀兩種物質的溶解度曲線。(請用鉛筆在答題卡的坐標紙上繪圖)________
②根據繪制的氯化鈉和硝酸鉀的溶解度曲線判斷,溫度大約在_____℃時,兩種物質的溶解度大小相等。
③現有氯化鈉和硝酸鉀各40g ,30℃時,分別加入兩只盛有100g水的燒杯中,能得到飽和溶液的是______(填溶質名稱), 將上述得到的不飽和溶液轉化為該溫度下的飽和溶液,可采用的方法是_____。
④在60℃時,硝酸鉀的溶解度是110g。這句話的含義是______。
(4)以太陽能為熱源,經由鐵氧化合物循環分解水的過程如右圖所示:
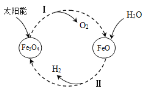
① 寫出在一定條件下發生的反應Ⅱ的化學方程式______。
② 在上述循環過程中,最終得到的產品是________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】實驗室配制100 g 溶質質量分數為5%的氯化鈉溶液。實驗操作如下:
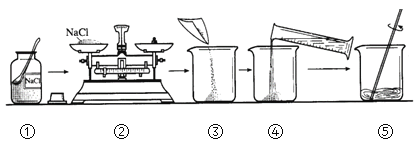
(1)操作④中量筒的量程是_____(填“10 mL”、“50 mL”或“100 mL”)。
(2)若操作③中有部分固體灑落桌面,所得溶液的溶質質量分數會_____(填“偏大”、“不變”或“偏小”)。
(3)配制好的溶液要裝在試劑瓶中,并貼好標簽。請在如圖的標簽中填上相應的內容。
 _____
_____
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】還原鐵粉是結構疏松的單質鐵,是重要的工業原料。
I.物質制備。還原鐵粉的某種制備工藝流程如下:
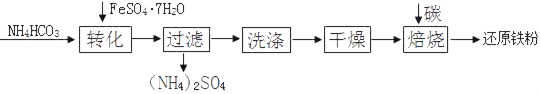
(1)“轉化”時溫度需控制在35℃以下,防止受熱分解的物質是_____。
(2)“干燥”過程中有少量的FeCO3轉化為FeOOH和CO2,此時與FeCO3反應的物質有_____(填化學式)
(3)FeCO3和 FeOOH在空氣中焙燒轉化為Fe2O3,FeOOH轉化為Fe2O3的反應類型是_____。寫出Fe2O3在高溫條件下與碳(C)反應生成Fe和CO2的化學方程式:_____。
Ⅱ.成分研究。“暖寶寶”一般由還原鐵粉、活性炭和氯化鈉等組成。
(實驗目的)測定未開啟的“暖寶寶”中鐵的質量分數。
(實驗過程)如圖五所示,甲同學稱得反應前總質量為85g,打開活塞待稀鹽酸全部滴入后立即關閉活塞。錐形瓶內的現象有:固體逐漸減少,_____。反應完畢后測得錐形瓶和反應后混合物的總質量為84.8g。
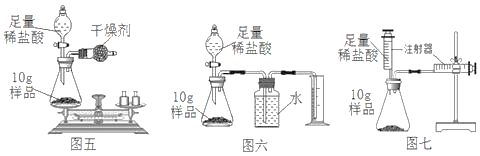
(評價反思)
(1)乙同學認為甲同學方案誤差較大,于是設計如圖六的方案。甲同學方案誤差較大的原因是_____。
(2)丙同學認為乙同學方案即使操作無失誤,測量結果仍會偏大,原因是_____。
(3)丙同學設計了圖七的實驗裝置。利用該裝置實驗時,在氣密性良好的前提下,如果往錐形瓶中注入的稀鹽酸體積為V1mL,等充分反應并且待裝置冷卻后,觀察右側注射器讀數増加V2mL.實驗條件下氫氣密度為 d g/mL.則樣品中鐵的質量分數為_____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】請用化學方程式表示下列物質制備的反應原理:
(1)工業上制取碳酸飲料必需的氣體原料________
(2)實驗室用固體混合物制取能供給呼吸的氣體________
(3)實驗室制取最理想的清潔、高能燃料________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com