
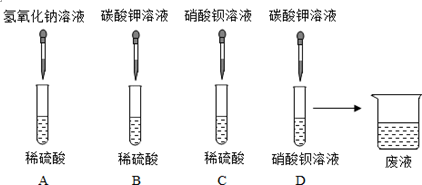
 .
.| 溶液中可能含有離子 | 實驗步驟 | 實驗現象 | 實驗結論 |
| ①可能含有 Ba2+ | ②取濾液滴加 硫酸鈉溶液 | 現象明顯 | 含有該離子 |
分析 【實驗探究】(1)①根據氫氧化鈉和硫酸反應生成硫酸鈉和水進行分析;
②根據碳酸鉀和硝酸鋇反應生成碳酸鋇沉淀和硝酸鉀進行分析;
【挖掘實質】根據中和反應的實質是氫離子和氫氧根離子反應生成水進行分析;
【實踐運用】(2)根據無色溶液滴加紫色石蕊試劑,變為紅色,說明得到無色溶液為酸性,亦說明白色沉淀不能溶于酸;
(3)根據氫離子與氫氧根離子和碳酸根離子不能共存;
(4)通過上述探究發現,在溶液中H+和OH-不能大量共存,我還發現在溶液中Ba2+和SO42-也不能大量共存;利用上述四種物質的溶液完成實驗后,將所得物質混合并過濾,得到一種無色溶液.經測定,該溶液顯酸性.則在該溶液中一定含有的離子是H+、Na+、K+和NO3-.
解答 解:【實驗探究】(1)①A中的反應氫氧化鈉和硫酸反應生成硫酸鈉和水,化學方程式為:2NaOH+H2SO4=Na2SO4+2H2O;
②D中的反應碳酸鉀與硝酸鋇反應生成碳酸鋇和硝酸鉀,化學方程式為:K2CO3+Ba(NO3)2=BaCO3↓+2KNO3;
【挖掘實質】中和反應的實質是氫離子和氫氧根離子反應生成水,表示為:H++OH-=H2O;
【實踐運用】(2)無色溶液滴加紫色石蕊試劑,變為紅色,說明得到無色溶液為酸性,酸過量,亦說明白色沉淀不能溶于酸,由“硫酸、硝酸銨、氫氧化鈉、碳酸鉀”四種物質看,沉淀一定是硫酸鋇,
(3)由于無色溶液滴加紫色石蕊試劑,變為紅色,說明得到無色溶液為酸性,酸過量,則溶液中一定不能含有氫氧根離子和碳酸根離子;
(4)通過上述探究發現,在溶液中H+和OH-不能大量共存,我還發現在溶液中Ba2+和SO42-也不能大量共存;利用上述四種物質的溶液完成實驗后,將所得物質混合并過濾,得到一種無色溶液.經測定,該溶液顯酸性.則在該溶液中一定含有的離子是H+、Na+、K+和NO3-
| 溶液中可能含有的離子 | 設計實驗驗證(實驗步驟、現象及對應的結論) |
| 可能性一:Ba2+ | 取上述溶液少量于試管中,加入少量硫酸鈉溶液.若出現白色沉淀,則說明上述溶液中含有Ba2+;若沒有出現白色沉淀,則說明上述溶液中不含有Ba2+. |
| 可能性二:SO42- | 取上述溶液少量于試管中,加入少量硝酸鋇溶液.若出現白色沉淀,則說明上述溶液中含有SO42-;若沒有出現白色沉淀,則說明上述溶液中不含有SO42-. |
| 溶液中可能含有離子 | 實驗步驟 | 實驗現象 | 實驗結論 |
| ①可能含有Ba2+ | ②取濾液滴加硫酸鈉溶液 | 現象明顯 | 含有該離子 |
點評 本題考查復分解反應及其反應條件.是化學中四大基本反應類型之一.它的概念是兩種化合物互相交換成分,生成兩種新的化合物的反應.沉淀、氣體、水是復分解反應發生的條件.


科目:初中化學 來源: 題型:選擇題
| A. | 硫化羰是氧化物 | |
| B. | 相同條件下,硫化羰的密度比空氣小 | |
| C. | 硫化羰可用作滅火劑 | |
| D. | 硫化羰在氧氣中完全燃燒后的生成物是CO2和SO2 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | Mg+O2$\frac{\underline{\;點燃\;}}{\;}$MgO2 | B. | 4Fe+3O2 $\frac{\underline{\;點燃\;}}{\;}$2Fe2O3 | ||
| C. | 2KMnO4═K2MnO4+MnO2+O2↑ | D. | C+O2$\frac{\underline{\;點燃\;}}{\;}$CO2 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 次氯酸鈉中氯元素的化合價為-1 | |
| B. | 次氯酸鈉是氧化物 | |
| C. | 過氧乙酸由三個元素組成 | |
| D. | 過氧乙酸中碳、氫、氧元素的原子個數比為2:4:3 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com