海洋是人類最大的資源寶庫,人類在逐步的開發和利用.某校化學實驗室有一包從海水中獲得、并經初步提純的粗鹽,現對其成分進行探究,并將粗鹽進一步提純.
[實驗一]這包粗鹽中還含有哪些雜質?
根據海水成分和初步提純的實驗操作,估計該粗鹽可能含有的雜質是CaCl2和MgCl2,現用實驗驗證這種推測:
第一步:取樣,加入適量水使樣品完全溶解,得溶液A;
第二步:取少量溶液A,并滴加足量NaOH溶液,觀察到______(填“有”或“無”)明顯實驗現象;
第三步:另取少量溶液A,并滴加足量Na2CO3溶液,出現白色沉淀.發生反應的化學方程式為______.
實驗證明,這包粗鹽中含有的雜質只有CaCl2.
[實驗二]這包粗鹽中NaCl的質量分數是多少?
第①步:稱取粗鹽樣品mg;
第②步:將樣品加水溶解,制成無色澄清溶液B;
第③步:向溶液B中加入過量的Na2CO3溶液,充分反應后過濾;
第④步:濾渣洗滌后小心烘干,得到純凈固體D,并稱得質量為ng;
第⑤步:濾液在進行某一操作后,移入蒸發皿蒸發,得到純凈氯化鈉固體,并稱得質量為ag;
(1)在②③⑤的步驟中,都使用到玻璃棒;其中在步驟②的作用是______;
(2)步驟⑤進行的“某一操作”是______;
(3)這包粗鹽中NaCl的質量分數是______.
解:實驗一:根據實驗結論知道,該粗鹽中不含氯化鎂,含有氯化鈣,加入氫氧化鈉后就不會生成沉淀了,碳酸鈉和氯化鈣反應生成碳酸鈣沉淀和氯化鈉,
故答案為:無,Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl
實驗二:(1)玻璃棒的攪拌可以加快水對固體的沖刷速度,也就加快了粗鹽的溶解,故答案為:加速溶解,
(2)經過前四步的反應后的溶液中除了氯化鈉,還有反應剩余的碳酸鈉,需要將碳酸根離子除去,故答案為:滴加適量稀鹽酸
(3)根據題中的敘述知道反應原理是碳酸鈉和氯化鈣反應生成碳酸鈣沉淀和氯化鈉,
設粗鹽中有氯化鈣為x,
Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl
111 100
x n
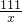
=
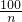
x=

克,
所以氯化鈉的質量分數為:
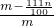
,經過化簡為:
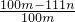
,
故答案為:
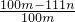
.
分析:實驗一:根據結論中的粗鹽的雜質進行分析,
實驗二:(1)根據玻璃棒的攪拌可以加快水對固體的沖刷速度進行分析,
(2)根據④步后的溶液中的成分進行分析,
(3)根據③④中得到的碳酸鈣沉淀的質量利用方程式求出氯化鈣的質量,然后再求出氯化鈉的質量,就可以求出質量分數了.
點評:在解此類題時,首先要從眾多的敘述中找出與解題有關的敘述,然后根據要求選擇適當的試劑和方法進行解答,通過該題,要會求粗鹽中氯化鈉的質量分數.

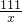 =
=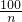
 克,
克,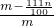 ,經過化簡為:
,經過化簡為: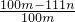 ,
,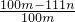 .
.
