
 某班一次社會實踐活動是到連云港堿廠參觀,該廠主要產品之一是小蘇打.參觀結束,同學們帶回一些化驗室里廢棄的小蘇打樣品,來測定其中小蘇打的質量分數(假設該樣品中只含有氯化鈉一種雜質).取樣品9.4g逐滴加入稀鹽酸,生成CO2氣體的質量與滴加稀鹽酸的質量關系如圖所示,NaHCO3+HCl═NaCl+H2O+CO2↑求:(計算結果保留到小數點后一位數字)
某班一次社會實踐活動是到連云港堿廠參觀,該廠主要產品之一是小蘇打.參觀結束,同學們帶回一些化驗室里廢棄的小蘇打樣品,來測定其中小蘇打的質量分數(假設該樣品中只含有氯化鈉一種雜質).取樣品9.4g逐滴加入稀鹽酸,生成CO2氣體的質量與滴加稀鹽酸的質量關系如圖所示,NaHCO3+HCl═NaCl+H2O+CO2↑求:(計算結果保留到小數點后一位數字)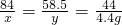
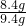 ×100%≈89.4%
×100%≈89.4%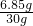 ×100%=22.8%
×100%=22.8%

 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:
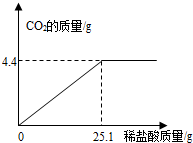 某班一次社會實踐活動是到連云港堿廠參觀,該廠主要產品之一是小蘇打(碳酸氫鈉).參觀結束,同學們帶回一些化驗室里廢棄的小蘇打樣品,來測定其中碳酸氫鈉的質量分數(假設該樣品中只含有氯化鈉一種雜質).取樣品9.3g逐滴加入稀鹽酸,生成CO2氣體的質量與滴加稀鹽酸的質量關系如圖所示,求:(計算結果用百分數表示,保留到小數點后一位數字)
某班一次社會實踐活動是到連云港堿廠參觀,該廠主要產品之一是小蘇打(碳酸氫鈉).參觀結束,同學們帶回一些化驗室里廢棄的小蘇打樣品,來測定其中碳酸氫鈉的質量分數(假設該樣品中只含有氯化鈉一種雜質).取樣品9.3g逐滴加入稀鹽酸,生成CO2氣體的質量與滴加稀鹽酸的質量關系如圖所示,求:(計算結果用百分數表示,保留到小數點后一位數字)查看答案和解析>>
科目:初中化學 來源: 題型:
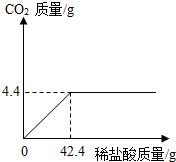 某班一次社會實踐活動是到堿廠參觀,該廠主要產品之一是純堿.參觀結束,同學們帶回一些化驗室里廢棄的純堿樣品,來測定其中碳酸鈉的質量分數(假設該樣品中只含有氯化鈉一種雜質).取樣品12g逐滴加入稀鹽酸,生成CO2氣體的質量與滴加稀鹽酸的質量關系如右圖所示,求:(計算結果用百分數表示,保留到小數點后一位數字)
某班一次社會實踐活動是到堿廠參觀,該廠主要產品之一是純堿.參觀結束,同學們帶回一些化驗室里廢棄的純堿樣品,來測定其中碳酸鈉的質量分數(假設該樣品中只含有氯化鈉一種雜質).取樣品12g逐滴加入稀鹽酸,生成CO2氣體的質量與滴加稀鹽酸的質量關系如右圖所示,求:(計算結果用百分數表示,保留到小數點后一位數字)查看答案和解析>>
科目:初中化學 來源: 題型:
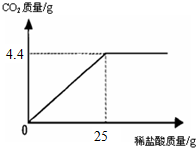 某班一次社會實踐活動是到連云港堿廠參觀,該廠主要產品之一是小蘇打.參觀結束,同學們帶回一些化驗室里廢棄的小蘇打樣品,來測定其中小蘇打的質量分數(假設該樣品中只含有氯化鈉一種雜質).取樣品9.4g逐滴加入稀鹽酸,生成CO2氣體的質量與滴加稀鹽酸的質量關系如圖所示,NaHCO3+HCl═NaCl+H2O+CO2↑求:(計算結果保留到小數點后一位數字)
某班一次社會實踐活動是到連云港堿廠參觀,該廠主要產品之一是小蘇打.參觀結束,同學們帶回一些化驗室里廢棄的小蘇打樣品,來測定其中小蘇打的質量分數(假設該樣品中只含有氯化鈉一種雜質).取樣品9.4g逐滴加入稀鹽酸,生成CO2氣體的質量與滴加稀鹽酸的質量關系如圖所示,NaHCO3+HCl═NaCl+H2O+CO2↑求:(計算結果保留到小數點后一位數字)查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com