
分析 根據反應前后的質量差求出生成二氧化碳的質量,根據化學方程式可求得參加反應的碳酸鈣的質量和生成的氯化鈣的質量,進而求質量分數
解答 解:設參加反應的碳酸鈣的質量為x,生成的氯化鈣的質量為y,由題意可知,反應后生產二氧化碳12+100-107.6═4.4g
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
$\frac{100}{x}=\frac{111}{y}=\frac{44}{4.4g}$
x=10g,y=11.1g
由題意可知,反應后溶液的質量為107.6-(12-10)═105.6g
反應后氯化鈣溶液中氯化鈣的質量分數為:$\frac{11.1g}{105.6g}×100%$=10.5%
答:反應后氯化鈣溶液中氯化鈣的質量分數為10.5%.
點評 根據反應的化學方程式能表示反應中各物質的質量關系,由反應中某物質的質量可計算出反應中其它物質的質量.


 優生樂園系列答案
優生樂園系列答案 新編小學單元自測題系列答案
新編小學單元自測題系列答案科目:初中化學 來源: 題型:實驗探究題
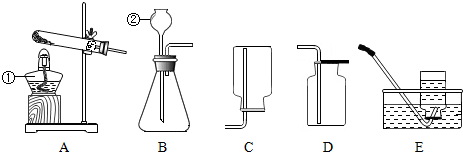
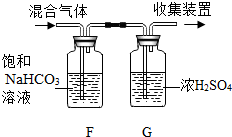
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
 如圖是A、B兩物質的溶解度曲線圖,據圖可知:
如圖是A、B兩物質的溶解度曲線圖,據圖可知:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
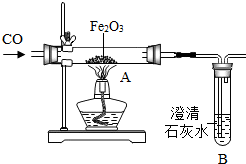 中國高鐵在“一帶一路”基礎設施的互聯互通中扮演著重要的角色.請結合所學知識回答相關問題:
中國高鐵在“一帶一路”基礎設施的互聯互通中扮演著重要的角色.請結合所學知識回答相關問題:查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:初中化學 來源: 題型:填空題
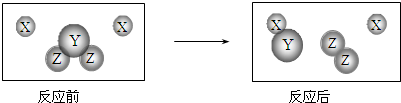
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com