
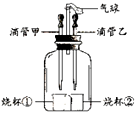
 某化學興趣小組設計如圖所示裝置,可以用來完成多個簡單實驗,具有藥品用量少、實驗現象明顯、尾氣不外逸等優點
某化學興趣小組設計如圖所示裝置,可以用來完成多個簡單實驗,具有藥品用量少、實驗現象明顯、尾氣不外逸等優點分析 (1)根據分子的特點考慮;
(2)根據酸堿鹽的性質以及驗證質量守恒定律應注意的事項進行解答;
(3)根據實驗現象分析實驗結論,同事掌握設計實驗的方法.
解答 解:(1)由于氨水和酚酞試液不在一個燒杯中,但酚酞試液變紅了,說明氨水進入了酚酞試液中,氨水顯堿性能使酚酞試液變紅,所以說明了氨分子在不斷運動,才運動到酚酞試液中的,所以說明分子在不斷運動,故填:酚酞試液變紅;在不斷的運動.
(2)若乙中吸有稀鹽酸,燒杯①中盛有澄清的石灰水,燒杯②中盛有碳酸鈉粉末.稀鹽酸與碳酸鈉反應生成氯化鈉、水和二氧化碳,二氧化碳能使澄清的石灰水變渾濁,因此為了驗證質量守恒定律,將裝置放在托盤天平左盤上調平,然后擠壓滴管乙的膠頭,觀察到燒杯②中有大量氣泡產生,燒杯①中變渾濁.反應結束后,指針仍然居中,由此可知,驗證質量守恒定律時,有氣體參加或有氣體生成時要在密閉容器中進行試驗,故填:有大量氣泡產生;變渾濁;密閉.
(3)若燒杯①、②中分別盛有等質量的二氧化錳粉末和氧化鐵粉末,滴管甲、乙中分別盛有等量等濃度的過氧化氫溶液,同時擠壓膠頭滴管,觀察到①比②中產生氣泡的速率快,據此可得出的結論是二氧化錳粉末比氧化鐵粉末更能促進過氧化氫的分解.影響化學反應速率的因素有很多,如反應物的濃度.燒杯①、②中分別盛有等質量的二氧化錳粉末和氧化鐵粉末,滴管甲、乙中分別盛有等量的過氧化氫溶液,但甲中過氧化氫的濃度高,同時擠壓膠頭滴管,觀察到①比②中產生氣泡的速率快,則反應物的濃度越高反應速率越快,故填:二氧化錳粉末比氧化鐵粉末更能促進過氧化氫的分解;反應物的濃度;燒杯①、②中分別盛有等質量的二氧化錳粉末和氧化鐵粉末,滴管甲、乙中分別盛有等量的過氧化氫溶液,但甲中過氧化氫的濃度高,同時擠壓膠頭滴管,觀察到①比②中產生氣泡的速率快,則反應物的濃度越高反應速率越快.
點評 此題難度較大,掌握酸堿鹽的化學性質以及設計實驗的方法等即可順利解答.


 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
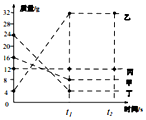 在一密閉容器中加入甲、乙、丙、丁四種物質,在下定條件下發生化學反應,測得反應前及t1、t2時各物質質量如圖所示,下列說法中不正確的是( )
在一密閉容器中加入甲、乙、丙、丁四種物質,在下定條件下發生化學反應,測得反應前及t1、t2時各物質質量如圖所示,下列說法中不正確的是( )| A. | 該反應為化合反應 | |
| B. | 丙可能為該反應的催化劑 | |
| C. | 該反應中,乙、丁的質量變化之比為7:5 | |
| D. | 該反應中,甲物質一定是單質 |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com