
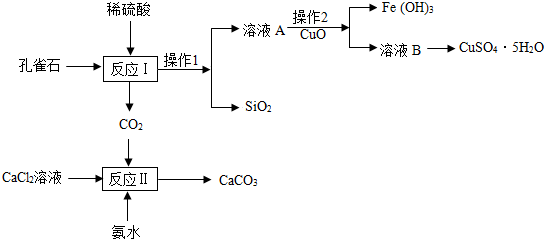
分析 (1)根據稀硫酸會與堿式碳酸銅、氧化鐵等物質反應進行分析;
(2)根據加入的稀硫酸是過量的,稀硫酸會與堿式碳酸銅、氧化鐵等物質反應進行分析;
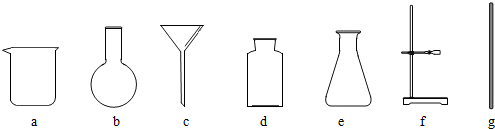
(3)根據操作1、操作2分離可以得到固體和液體,所以該操作是過濾,依據過濾需要的儀器進行分析;
(4)根據濾液A獲得CuSO4•5H2O,需加熱蒸發、冷卻結晶、過濾等操作進行分析;
(5)根據化合價代數和為零,氧化銅會與稀硫酸反應生成硫酸銅進行分析;
(6)根據質量守恒定律,碳酸鈉會與氯化鈣反應生成碳酸鈣沉淀進行分析.
解答 解:(1)稀硫酸會與堿式碳酸銅、氧化鐵等物質反應,所以反應Ⅰ硫酸需過量的原因是:使孔雀石完全反應;
(2)加入的稀硫酸是過量的,稀硫酸會與堿式碳酸銅、氧化鐵等物質反應,所以溶液A中含有的溶質是:硫酸銅、硫酸鐵、硫酸;
(3)操作1、操作2分離可以得到固體和液體,所以該操作是過濾,依據過濾需要的儀器,過濾要用到燒杯、鐵架臺、漏斗和玻璃棒,故選:acfg;
(4)濾液A獲得CuSO4•5H2O,需加熱蒸發、冷卻結晶、過濾等操作;
(5)Fe(OH)3中的鐵元素化合價為+3,氧化銅會與稀硫酸反應生成硫酸銅,消耗稀硫酸,所以溶液的pH變大;
(6)反應物中含有1個碳原子,1個鈣原子,4個氧原子,2個氯原子,10個氫原子,生成物中含有1個鈣原子,1個碳原子,2個氫原子,4個氧原子,所以另一種物質是氯化銨,所以化學方程式為:CaCl2+2NH3+CO2+H2O═CaCO3↓+2NH4Cl+H2O,碳酸鈉會與氯化鈣反應生成碳酸鈣沉淀,所以應向CaCl2溶液中先加入(或先通入)氨氣,從反應Ⅱ所得CaCO3需經過“洗滌”這步操作,判斷沉淀已洗滌干凈的操作方法是:取洗滌后的液體,滴加碳酸鈉溶液,若無白色沉淀,則已洗凈.
故答案為:(1)使孔雀石完全反應;
(2)硫酸銅、硫酸鐵、硫酸;
(3)acfg;
(4)冷卻結晶;
(5)+3,變大;
(6)2NH4Cl,氨氣,取洗滌后的液體,碳酸鈉.
點評 本題考查以孔雀石為原料制備CuSO4•5H2O及CaCO3的實驗流程,要根據已有知識弄清各步操作然后結合所學知識和題中信息解答.


科目:初中化學 來源: 題型:選擇題
| A. | 50% | B. | 48.8% | C. | 38.2% | D. | 72.3% |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com