大理石25g,與200g稀鹽酸與恰好完全反應(雜質不參加反應也不溶于水),反應后得剩余物質的總質量為216.2g(設二氧化碳全部放出),求:
(1)生成二氧化碳的質量
(2)大理石中碳酸鈣的質量分數
(3)反應后所得溶液中溶質的質量分數.
解:(1)由質量守恒可知,二氧化碳的質量為25g+200g-216.2g=8.8g,
(2)設碳酸鈣的質量為x,生成的氯化鈣的質量為y,
則CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑,
100 111 44
x y 8.8g

解得x=20g,y=22.2g,
該樣品中碳酸鈣的質量分數為
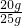
×100%=80%,
(3)因雜質既不溶于水,也不與其他物質反應,則溶液的質量為216.2g-(25g-20g)=211.2g,溶質的質量為22.2g,則溶質的質量分數為
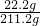
×100%≈10.5%;
答:(1)反應生成二氧化碳的質量是8.8g;(2)石灰石中含碳酸鈣的質量分數為80%.(3)反應后所得溶液的溶質質量分數是10.5%;
分析:(1)根據該反應中只有二氧化碳是氣體,則利用質量守恒定律和反應前后燒杯中物質的總質量之差來計算二氧化碳的質量;
(2)將二氧化碳的質量代入化學反應方程式來計算碳酸鈣的質量,再計算碳酸鈣的質量分數;
(3)利用化學反應方程式計算出氯化鈣的質量,再利用溶液的質量來計算溶質的質量分數.
點評:本題考查學生利用化學反應方程式的計算,明確二氧化碳是氣體并利用質量守恒來計算二氧化碳的質量是解答的關鍵.


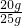 ×100%=80%,
×100%=80%,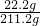 ×100%≈10.5%;
×100%≈10.5%;
