
| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加人稀硫酸質量/g | 50 | 50 | 50 | 50 |
| 剩余固體質量/g | 43.5 | 37.0 | 33.75 | 33.75 |
分析 (1)根據鋅會與硫酸反應,銅不會與硫酸反應,反應剩余的物質是銅,然后計算銅的質量分數;
(2)根據第一次與第二次的反應情況可以看出每50g硫酸消耗鋅的質量是43.5-37=6.5g,然后利用三四次的反應中固體不變確定,50g樣品中鋅的質量是
50g-33.75g=16.25g,從而計算出反應時硫酸的消耗量;
(3)根據測得數據記錄表,第2次加入稀硫酸后剩余固體質量繼續減少,說明第1次所加入的稀硫酸完全反應,根據此時反應消耗鋅的質量,計算所加入稀硫酸中溶質硫酸的質量,即可求得所用稀硫酸的溶質質量分數.
解答 解:(1)鋅會與硫酸反應,銅不會與硫酸反應,反應剩余的物質是銅,所以銅鋅合金中銅的質量分數為:$\frac{33.75g}{50g}$×100%=67.5%;
(2)由表中提供的數據可知該樣品中含有的鋅的質量=50g-33.75g=16.25g,由第一次與第二次可以得到:每50g硫酸消耗鋅的質量是43.5-37=6.5g,所以反應的鋅的質量是16.25g時,消耗的硫酸的質量是100g+25g=125g;
(3)依據題意,第一次中參加反應的鋅的質量為50g-43.5g=6.5g,設參加反應的H2SO4質量為x
Zn+H2SO4=ZnSO4+H2↑
65 98
6.5g x
$\frac{65}{6.5g}$=$\frac{98}{x}$
x=9.8g
則所用稀硫酸的溶質質量分數=$\frac{9.8g}{50g}$×100%=19.6%.
故答案為:(1)67.5%;
(2)125;
(3)19.6%.
點評 利用實驗數據中變化量的變化關系,分析反應的進行情況,對后面的計算時數據選擇起著決定性作用;只有使用物質完全反應時的實驗數據進行計算才能得到正確的結果.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:初中化學 來源: 題型:實驗探究題
 某同學發現,上個月做實驗用的NaOH溶液忘記了蓋瓶蓋.對于該溶液是否變質,同學們開始實驗探究.
某同學發現,上個月做實驗用的NaOH溶液忘記了蓋瓶蓋.對于該溶液是否變質,同學們開始實驗探究.| 實驗操作 | 可能出現的現象與結論 | 同學評價 | |
| 第1組 | 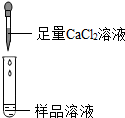 | 若溶液變紅,則猜想(2)不成立 | 第2組同學認為:此方案結論不正確,理由是碳酸鈉溶液呈堿性,也能使酚酞試液變紅 |
| 第2組 | 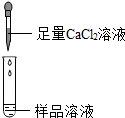 | 若產生白色沉淀,則猜想(1)不成立. | 第3組同學認為:此方案還不能確定猜想(2)還是猜想(3)成立. |
| 第3組 | 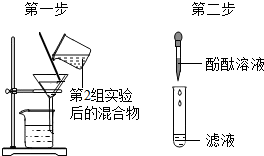 | 若濾液不變紅,則猜想(2)成立;若濾液變紅,則猜想(3)成立. | 第1組同學認為:不需過濾也能達到實驗目的,更簡單的操作方法是將第二組實驗靜置之后取上層清液 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| 選項 | 物質 | 雜質 | 試劑 |
| A | NaNO3 | Na2CO3 | CaCl2 |
| B | ZnSO4 | CuSO4 | Zn粉 |
| C | Na2SO4 | NaHCO3 | HCl |
| D | CuO | Cu | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
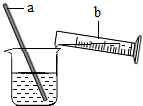 如圖是稀釋濃硫酸實驗的示意圖.
如圖是稀釋濃硫酸實驗的示意圖.查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | CO | B. | CO2 | C. | O2 | D. | 什么氣體都沒有 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
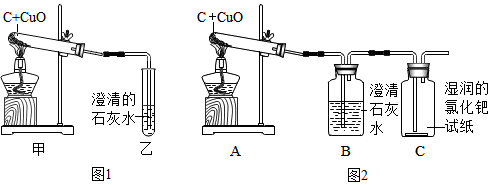
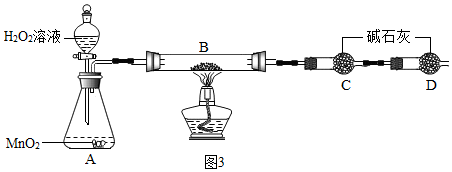
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com