
| 項目 | 甲 | 乙 | 丙 |
| 所取固體樣品質量(克) | 20 | 10 | 10 |
| 加入AgNO3溶液的質量(克) | 100 | 100 | 200 |
| 反應后所得的沉淀質量(克) | 14.35 | 14.35 | 14.35 |
分析 (1)由生成沉淀的質量根據硝酸銀與氯化鉀反應的化學方程式可以計算出樣品中氯化鉀的質量和生成硝酸鉀的質量,進而計算出樣品中氯化鉀的質量分數.
(2)只有恰好完全反應時,所得溶液中的溶質和原固體中所含的雜質才是同一種物質.所得溶液中溶質的質量由生成的硝酸鉀和固體中含有的硝酸鉀兩部分組成;所得溶液的質量為固體質量與硝酸銀溶液的質量和去掉生成沉淀的質量.根據溶質質量分數的計算公式可以計算出所得溶液中溶質的質量分數.
解答 解:甲、乙兩組數據對照,說明甲中固體過量,硝酸銀溶液完全反應;乙、丙兩組數據對照,說明丙中硝酸銀溶液過量,固體完全反應;以上分析說明乙中固體與硝酸銀溶液恰好完全反應.計算時應以乙組數據為準.
(1)設樣品中氯化鉀的質量分數為x,生成硝酸鉀的質量為y.
KCl+AgNO3=AgCl↓+KNO3
74.5 143.5 101
10g×x 14.35g y
$\frac{74.5}{10g×x}=\frac{143.5}{14.35g}=\frac{101}{y}$
x=74.50%,y=10.1g
(2)所得溶液中溶質的質量分數為$\frac{10g×(1-74.5%)+10.1g}{10g+100g-14.35g}$×100%≈13.23%
答:(1)樣品中氯化鉀的質量分數為74.50%;
(2)乙;所得溶液中溶質的質量分數為13.23%.
點評 本題主要考查有關含雜質物質的化學方程式計算,難度較大.


科目:初中化學 來源: 題型:實驗探究題
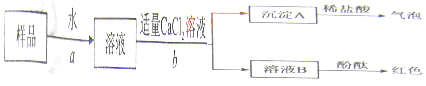
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
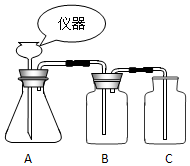 根據如圖裝置回答下列問題:
根據如圖裝置回答下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 有酸味的物質 | B. | 一切酸中都含有氧 | ||
| C. | 只有氫才是酸不可缺少的元素 | D. | 與堿作用時失去原有性質的物質 |
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
查看答案和解析>>
科目:初中化學 來源: 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com