

分析 (1)根據已有的金屬的性質進行分析解答,在金屬活動性順序中,位置在前的金屬能將位于其后的金屬從其鹽溶液中置換出來,據此解答;
(2)由題意知,反應物為鐵和水蒸氣、生成物為四氧化三鐵和氫氣、反應條件為高溫,故可書寫化學方程式;由化學方程式判定反應類型;
(3)根據相同時間內產生氫氣較多(即反應劇烈)的金屬活動性較強,結合產生氫氣的關系圖判斷三種金屬活動性;
根據一定質量的質量完全反應產生氫氣的質量=$\frac{金屬的化合價}{金屬的相對原子質量}$×金屬的質量,結合三種金屬的化合價及完全反應放出氫氣的質量大小,判斷三種金屬的相對原子質量的大小;
(4)Fe、Mg、Zn三種金屬分別跟稀鹽酸反應的化學方程式為:Fe+2HCl=FeCl2+H2↑,Mg+2HCl=MgCl2+H2↑,Zn+2HCl=2ZnCl2+H2↑,由此可知,產生氫氣的是鹽酸中的氫離子,故要得到相同質量的氫氣有兩種情況:①參與反應的HCl的質量相等;②參與反應的Fe、Mg、Zn的質量符合得到相同質量的氫氣的條件
解答 解:(1)銅制火鍋利用的是銅的導熱性,故填:②;
(2)由題意知,反應物為鐵和水蒸氣、生成物為四氧化三鐵和氫氣、反應條件為高溫,故可書寫化學方程式為3Fe+4H2O$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2;此反應符合“單質+化合物=單質+化合物,即A+BC=B+AC”,即為置換反應;
故答案為:3Fe+4H2O(氣)$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2 ;置換;
(3)A、根據反應生成H2的質量與反應時間的關系圖所示,當三種金屬都在發生反應時,相同時間內B放出氫氣的質量大于,故A不正確;
B、大于C,可判斷三種金屬中B的活動性最強根據反應生成H2的質量與反應時間的關系圖所示,在三種金屬完全反應后,放出H2的質量是A>B>C,故B正確;
C、三種金屬的化合價、金屬的質量都相等,完全反應放出氫氣的質量與金屬的相對原子質量成反比,即產生氫氣多的相對原子質量小;根據反應生成H2的質量與反應時間的關系圖所示,在三種金屬完全反應后,放出H2的質量是A>B>C;因此可判斷相對原子質量是C>B>A;故C不正確;
D、根據反應生成H2的質量與反應時間的關系圖所示,等質量的三種金屬B最先完全反應,因此反應速度最大的是B而不是A;故D不正確;
故選B
(4)①因為產生氫氣的是鹽酸中的氫離子,故參與反應的HCl的質量相等,產生的氫氣的質量就相等.故D符合;
②假設Fe、Mg、Zn 三種金屬分別跟稀鹽酸充分反應,得到氫氣的質量都是2g,
設參與反應的Fe的質量為x,Mg的質量為y,Zn的質量為z,
Fe+2HCl=FeCl2+H2↑,Mg+2HCl=MgCl2+H2↑,Zn+2HCl=2ZnCl2+H2↑,
56 2 24 2 65 2
x 2g y 2g z 2g
$\frac{56}{x}=\frac{2}{2g}$,$\frac{24}{y}=\frac{2}{2g}$,$\frac{65}{z}=\frac{2}{2g}$
解之得:x=56g,y=24g,z=65g,
故Mg、Zn、Fe的質量比為:24g:65g:56g=24:65:56.
故B符合;C不符合;
故選BD.
點評 在利用化學方程式解答問題時,運用假設法,對解題有很大作用.培養學生分析問題、解決問題的能力.


科目:初中化學 來源: 題型:選擇題
| A. | 氧化物一定含有氧元素,所以含氧元素的物質一定是氧化物 | |
| B. | 化學反應前后原子種類不變,數目沒有增減,所以化學反應一定遵循質量守恒定律 | |
| C. | 燃燒一般都伴隨發光、放熱現象,所以有發光、放熱的現象就是燃燒 | |
| D. | 碳酸鹽與鹽酸反應放出氣體,所以與鹽酸反應放出氣體的物質一定是碳酸鹽 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
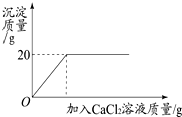 將一定質量的碳酸鈉粉末溶于200g水中配制成溶液,向該溶液中加入20%的氯化鈣溶液至不再產生白色沉淀,所得產生沉淀的質量與加入氯化鈣溶液的質量關系如圖所示,試計算:恰好完全反應不再產生白色沉淀時所用氯化鈣溶液的質量.
將一定質量的碳酸鈉粉末溶于200g水中配制成溶液,向該溶液中加入20%的氯化鈣溶液至不再產生白色沉淀,所得產生沉淀的質量與加入氯化鈣溶液的質量關系如圖所示,試計算:恰好完全反應不再產生白色沉淀時所用氯化鈣溶液的質量.查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com