化學興趣小組對某生鐵樣品中鐵的質量分數進行探究.請按要求完成下列探究報告.
[實驗目的]
測定某生鐵樣品中單質鐵的質量分數.
[資料支撐]
生鐵中除鐵外,還含有碳、硅、錳、磷和硫等元素.
碳在生鐵中以兩種形態存在,一種是游離碳(石墨),另一種是化合碳(如Fe3C等);硅、錳、磷、硫存在形式較為復雜;這些物質通常都不與稀硫酸發生化學反應.
[實驗方案]
生鐵樣品與過量的稀硫酸反應,測定反應前后可稱量物質的質量差.
[實驗過程]
(1)取一只燒杯,稱得其質量為70.4g,加入一定量生鐵樣品碎屑,稱得燒杯和樣品的總質量為102.4g;
(2)向盛有生鐵樣品的燒杯中加入稀硫酸,邊加邊攪拌,直到燒杯中不再產生氣泡,再加入少量稀硫酸以確保過量,測得共用去稀硫酸247.3g;
(3)靜置,稱量.稱得燒杯和剩余物質的總質量為348.7g.
[數據處理]
計算該生鐵樣品中單質鐵的質量分數:______(寫出計算過程)
[交流討論][
(1)實驗稱量時稱量物應放在托盤天平的______盤(選填“左”或“右”);
(2)實驗過程中稀硫酸要過量的原因是______;
(3)經質檢部門精確測定,該樣品中鐵元素的總含量為95.2%.假設沒有與硫酸反應的鐵都以Fe3C形式存在,則樣品中Fe3C的質量分數為______.
【答案】
分析:燒杯中減少的質量是生成氫氣的質量,根據鐵與稀硫酸反應的化學方程式可以計算出樣品中單質鐵的質量.進而計算出樣品中單質鐵的質量分數.
由樣品質量和樣品中鐵元素的質量分數,可以計算出樣品中鐵元素的總質量,去掉單質鐵的質量,就是沒有與稀硫酸反應的鐵元素的質量,根據物質中某元素的質量分數的計算公式可以計算出樣品中Fe
3C的質量,進而計算出樣品中Fe
3C的質量分數.
解答:解:生成H
2的質量:102.4g+247.3g-348.7g=1.0g
設生鐵樣品中含鐵的質量為x.
Fe+H
2SO
4═FeSO
4+H
2↑
56 2
x 1.0g
根據:
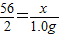
解得x=28.0g
生鐵樣品中鐵單質的質量分數為
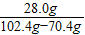
×100%=87.5%
答:生鐵樣品中鐵單質的質量分數是87.5%.
(1)稱量時物品放在天平的左盤,砝碼放在天平的右盤
(2)實驗過程中稀硫酸要過量的原因是確保生鐵樣品中鐵單質與稀硫酸完全反應
(3)設樣品質量為100g,則樣品中鐵元素的總質量為
100g×95.2%=95.2g.
鐵單質的質量為100g×87.5%=87.5g
樣品中Fe
3C的鐵元素質量為95.2g-87.5g=7.7g
7.7g÷(
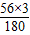
×100%)=8.25g
樣品中Fe
3C的質量分數為

×100%=8.25%
答:生鐵樣品中單質鐵的質量分數為87.5%
故答案為:87.5%;(1)左;(2)確保生鐵樣品中鐵單質與稀硫酸完全反應;(3)8.25%.
點評:本題主要考查有關化學方程式的計算和化學式的計算,難度較大.

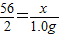 解得x=28.0g
解得x=28.0g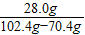 ×100%=87.5%
×100%=87.5%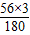 ×100%)=8.25g
×100%)=8.25g ×100%=8.25%
×100%=8.25%
