
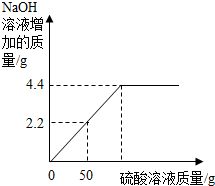
 菱鎂礦的主要成分是MgCO3,為了分析某菱鎂礦中鎂元素的含量,某學習小組進行了實驗研究.取10g菱鎂礦,逐漸加入未知濃度的H2SO4溶液,生成的氣體全部用NaOH溶液吸收,加入硫酸溶液的質量與NaOH溶液增加的質量變化關系記錄如下圖(菱鎂礦中的雜質不溶于水,不與酸發生反應),求
菱鎂礦的主要成分是MgCO3,為了分析某菱鎂礦中鎂元素的含量,某學習小組進行了實驗研究.取10g菱鎂礦,逐漸加入未知濃度的H2SO4溶液,生成的氣體全部用NaOH溶液吸收,加入硫酸溶液的質量與NaOH溶液增加的質量變化關系記錄如下圖(菱鎂礦中的雜質不溶于水,不與酸發生反應),求分析 (1)根據氫氧化鈉和二氧化碳反應生成碳酸鈉和水,所以氫氧化鈉溶液增加的質量就是二氧化碳的質量;
(2)根據碳酸鎂和硫酸反應生成硫酸鎂、二氧化碳和水,依據二氧化碳的質量求出碳酸鎂的質量,進而求出鎂元素的質量分數;
(3)根據二氧化碳的質量求出參加反應的硫酸的質量,再求出硫酸的質量分數.
解答 解:(1)氫氧化鈉和二氧化碳反應生成碳酸鈉和水,所以氫氧化鈉溶液增加的質量就是二氧化碳的質量,通過圖象可以看出生成二氧化碳的質量是4.4g;
(2)設菱鎂礦中MgCO3的質量為x,
MgCO3+H2SO4=MgSO4+H2O+CO2↑
84 98 120 44
x 4.4g
$\frac{84}{x}$=$\frac{44}{4.4g}$
x=8.4g
所以菱鎂礦中鎂元素的質量分數為:$\frac{8.4g×\frac{24}{84}×100%}{10g}$×100%=24%;
(3)設參加反應的硫酸是y時,生成的二氧化碳質量為2.2g
MgCO3+H2SO4=MgSO4+H2O+CO2↑
98 44
y 2.2g
$\frac{98}{y}$=$\frac{44}{2.2g}$
y=4.9g
所以硫酸的質量分數為:$\frac{4.9g}{50g}$×100%=9.8%.
故答案為:(1)4.4g;
(2)菱鎂礦中鎂元素的質量分數為24%;
(3)硫酸的質量分數為9.8%.
點評 本題是一道綜合性很強的根據化學方程式計算,只要找準已知量和相應未知量是解答此類題目的關鍵所在.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題

查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
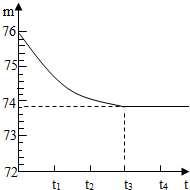 淄博市位于魯中山地和華北平原的接壤處,具有豐富的石灰石礦產資源.南部山區某礦山的石灰石樣品中含有二氧化硅雜質(二氧化硅是一種既不溶于水也不與鹽酸反應且耐高溫的固體).陽光學校的同學們想測定該樣品中碳酸鈣的質量分數,他們采取了一塊石灰石樣品,將其敲碎后,稱出6g放入燒杯內(燒杯質量為20g). 然后加入50g某一定溶質質量分數的稀鹽酸,用玻璃棒攪拌至不再產生氣泡為止.反應所需時間(t)和燒杯及其所盛物質總質量(m)的關系如圖所示.試回答:
淄博市位于魯中山地和華北平原的接壤處,具有豐富的石灰石礦產資源.南部山區某礦山的石灰石樣品中含有二氧化硅雜質(二氧化硅是一種既不溶于水也不與鹽酸反應且耐高溫的固體).陽光學校的同學們想測定該樣品中碳酸鈣的質量分數,他們采取了一塊石灰石樣品,將其敲碎后,稱出6g放入燒杯內(燒杯質量為20g). 然后加入50g某一定溶質質量分數的稀鹽酸,用玻璃棒攪拌至不再產生氣泡為止.反應所需時間(t)和燒杯及其所盛物質總質量(m)的關系如圖所示.試回答:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com