
 ×100%計算即可;
×100%計算即可; ×100%,兩個質量分數之差就是液體中氫元素的質量分數增加的數值.
×100%,兩個質量分數之差就是液體中氫元素的質量分數增加的數值.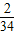 ×100%+97g×
×100%+97g×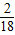 ×100%=10.98g
×100%=10.98g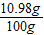 ×100%=10.98%≈11.0%;
×100%=10.98%≈11.0%;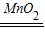 2H2O+O2↑
2H2O+O2↑ =
=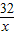
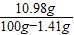 ×100%≈11.1%,
×100%≈11.1%,

科目:初中化學 來源: 題型:
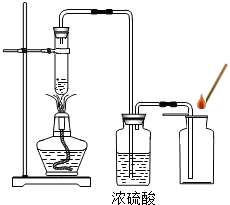 某學校化學興趣小組同學在學習了制取氧氣這一節內容后,發現在實驗室里用5%H2O2溶液加熱制O2,用帶火星的木條檢驗,木條很難復燃.同學們經過認真觀察,猜想其可能原因是
某學校化學興趣小組同學在學習了制取氧氣這一節內容后,發現在實驗室里用5%H2O2溶液加熱制O2,用帶火星的木條檢驗,木條很難復燃.同學們經過認真觀察,猜想其可能原因是
| ||
| ||
查看答案和解析>>
科目:初中化學 來源: 題型:閱讀理解
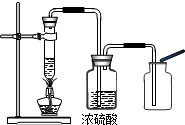 之一是
之一是查看答案和解析>>
科目:初中化學 來源: 題型:
查看答案和解析>>
科目:初中化學 來源:不詳 題型:問答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com