
【題目】根據下列的實驗常用儀器回答有關問題。
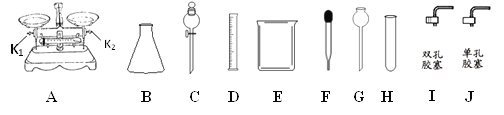
(1)儀器B的名稱是__________,儀器G的名稱是___________。
(2)現有一瓶溶質質量分數為35%的濃鹽酸,將其稀釋配制100g溶質質量分數為10%的稀鹽酸,若不使用儀器A,查閱資料,必需知該濃鹽酸有關________的數據,從而可以利用上述儀器中的D、E、玻璃棒和儀器_______(填序號)配制溶液。實驗室制取CO2,裝配一個是能夠控制反應速率的發生裝置,應選用上述儀器中的__________,其反應方程式為____________________________。
(3)用儀器A稱量5g的NaCl固體,需要儀器A進行調平:游碼歸零,在兩端的托盤分別放等質量的________,調節兩端的平衡螺母,若天平往左端傾斜,應該將K2往_________(選填“左”或“右”,下同)調節。
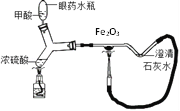
(4)某微型實驗裝置如圖,甲酸與熱的濃硫酸反應生成CO ,利用CO還原氧化鐵,反應過程中氧化鐵的顏色變化為______。 澄清石灰水處的現象是___________,該裝置為微型實驗裝置,微型實驗的優點是__________________。
【答案】 錐形瓶 長頸漏斗 密度 F BCI或CHI CaCO3 + 2HCl =CaCl2 +H2O +CO2↑ 稱量紙或燒杯 右 由紅色變成黑色 澄清石灰石變渾濁(或者變渾濁) 消耗藥品少、所用儀器和操作簡單、污染少、符合綠色化學理念(意思對即可)
【解析】本題考查了溶液的稀釋,實驗室制取二氧化碳的發生裝置改進,煉鐵原理裝置的改進。
(1)儀器B的名稱是錐形瓶,儀器G的名稱是長頸漏斗;
(2)稀釋配制100g溶質質量分數為10%的稀鹽酸,需要知道濃鹽酸的質量,不用天平稱量,還可根據M=ρV,必需知該濃鹽酸有關密度的數據,從而可以利用上述儀器中的D、E、玻璃棒和儀器F;實驗室制取二氧化碳的反應物是固體和液體,反應條件是常溫,分液漏斗能控制液體的滴加速率,能控制反應的速率,所以應選上述儀器中的BCI或CHI來組裝發生裝置;碳酸鈣與鹽酸反應生成氯化鈣、水和二氧化碳,反應方程式為CaCO3 + 2HCl =CaCl2 +H2O +CO2↑;
(3)用天平稱量5g的NaCl固體,需要將天平進行調平:游碼歸零,在兩端的托盤分別放等質量的稱量紙或燒杯,調節兩端的平衡螺母,若天平往左端傾斜,應該將K2往右調節;
(4)①一氧化碳和氧化鐵在高溫的條件下生成鐵和二氧化碳,氧化鐵的顏色變化是:由紅色變成黑色;二氧化碳能使澄清的石灰水變渾濁,澄清石灰水處的現象是澄清石灰石變渾濁(或者變渾濁);微型實驗的優點是消耗藥品少、所用儀器和操作簡單、污染少、符合綠色化學理念(意思對即可)。


 同步輕松練習系列答案
同步輕松練習系列答案 課課通課程標準思維方法與能力訓練系列答案
課課通課程標準思維方法與能力訓練系列答案科目:初中化學 來源: 題型:
【題目】過氧化鎂(MgO2)是一種鎂精細化工產品。在醫療上可用來治療消化不良、胃酸過多等疾病。在環境保護方面,過氧化鎂可用來處理地下水污染的土壤。還可以用于牙膏,對牙齒有漂白和防過敏的作用。某化學興趣小組對過氧化鎂的性質和制備等進行了以下研究。
一.過氧化鎂的性質
(1)過氧化鎂(其中氧元素的化合價為 __________)是一種白色的粉末,其外觀與物理性質與氧化鎂相似。化學性質不夠穩定,不溶于水,但逐漸的被分解放出氧氣。過氧化鎂有強氧化性,常溫下比較穩定,但是加熱時會分解生成氧氣和氧化鎂。請下出該反應的化學方程式____________。
(2)過氧化鎂易溶于稀鹽酸,發生反應:MgO2+2HCl=MgCl2+H2O2同時溫度升高,說明該反應_______________熱量(填“放出”或“吸收”)。
二.過氧化鎂的制備
下圖是利用堿式碳酸鎂【Mg2( OH)2CO3】和30%的過氧化氫溶液來制取過氧化鎂。
【資料】①堿式碳酸鎂與碳酸鎂有相似的化學性質,能與稀鹽酸反應產生二氧化碳
②氧化鎂與過氧化氫反應放出大量的熱
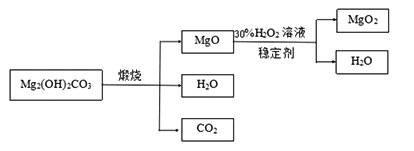
(3)檢測煅燒過程堿式碳酸鎂完全分解的方法是_________________(寫出具體的操作和現象);上述生產過程加入穩定的劑的作用是_________________。
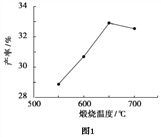
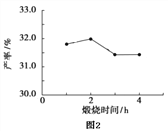
(4)用上述堿式碳酸鎂在 550、600、650 及 700 ℃ 下煅燒一定的時間生成氧化鎂。用上述條件制備的氧化鎂分別與 30% 雙氧水反應合成過氧化鎂產率(見圖1和圖2)。堿式碳酸鎂煅燒的溫度適宜控制在______℃,煅燒的時間適宜控制在_____h。
(5)結果分析:在適宜的溫度和時間下,堿式碳酸鎂能完全分解,并且得到的氧化鎂顆粒表面積最大,能與30%過氧化氫充分反應,所以產率高。推測700℃時,產率明顯降低的可能的原因__________。
三.過氧化鎂產品純度檢測
在生產過程中,過氧化鎂中常常含有少量的氧化鎂雜質(其他雜質不考慮),以下是該小組進行純度檢測的實驗裝置和實驗步驟。
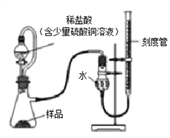
檢查裝置氣密性,裝入藥品(樣品質量為0.7g),調節刻度管使左右兩邊液面相平,刻度管度數為10.0mL。
打開分液漏斗開關,待瓶中無氣泡產生時,關閉開關。
再次調節刻度管使左右兩邊液面相平,刻度管度數為122mL。
(6)稀鹽酸中放入的少量硫酸銅溶液目的是__________________。
(7)根據上面實驗數據計算樣品中過氧化鎂的質量分數__________(寫出具體的計算過程,實驗條件下O2密度為1.429g/L)。
(8)該小組同學所測得質量分數比實際結果偏大,你覺得可能的原因是(_______)
A.生成的氧氣有少量溶于水 B.未等裝置冷卻到室溫就開始讀數
C.雜質與鹽酸反應能產生少量的氣體 D.滴入的稀鹽酸占了一部分氣體的體積
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】下圖是A.B兩種物質的溶解度曲線,根據圖示回答下列問題:
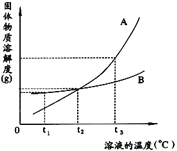
(1)t1℃時,向兩只盛有100g水的燒杯中,分別加入A.B兩種物質至不能溶解為止,所得溶液的溶質質量分數較大的是___________溶液(填“A”或“B”)。
(2)t2℃時,欲配制等質量的A.B兩種物質的飽和溶液,所需水的質量關系是A___________B。 (填寫“>”、“<”或“=”,下同)
(3)將t2℃的A.B兩種物質的飽和溶液各200g,降溫至t1℃,析出晶體的質量關系是A_______B。
(4)將t2℃的A、B兩種物質的飽和溶液各200g,升溫至t3℃,欲使它們仍為飽和溶液,若不改變溶劑質量,所需加入固體溶質的質量關系是A_______B。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】銅是人類最早利用的金屬之一。
(1)下列銅制品中,利用金屬導熱性的是____________(填字母序號)。

(2)“濕法煉銅”的原理是硫酸銅溶液與鐵反應,該反應的化學方程式為______.
(3)利用廢舊電池銅帽(含Cu、Zn)制取海綿銅(Cu),并得到硫酸鋅溶液,主要流程如下(反應條件已略去):
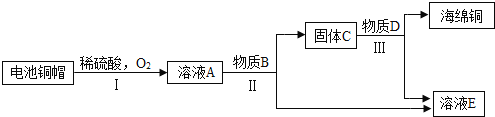
已知:2Cu+2H2SO4+O2=2CuSO4+2H2O
①過程Ⅱ中分離操作的名稱是____________。
②A~E中含銅、鋅兩種元素的物質有____________(填字母序號)
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】元素周期表是我們學習化學的重要工具。下表是小華繪制的元素周期表的局部,依據此表回答問題:
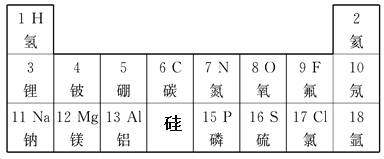
(1)第14號元素的元素符號為______;
(2)地殼中含量最多的元素為_______(填元素符號),其原子的質子數是______,在化學反應中它易______(填“得到”或“失去”)電子。
(3)鈉元素在元素周期表中位于第________周期。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】請根據A、B兩種固體物質的溶解度曲線圖回答下列問題。
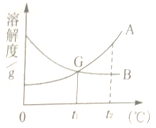
﹙1﹚溫度為________℃時,A與B物質的溶解度相等;
﹙2﹚在保持其中溶解質量不變的條件下,將常溫下B的不飽和溶液變成飽和溶液,可
行的方法是________。
﹙3﹚現有一杯t1℃時含A、B的兩種物質且飽和的混合溶液,若要從中分離出A,其操作方法是______。
﹙4﹚下列說法正確的是________。
A.t2℃時,A溶液中溶質的質量分數一定比B溶液中溶質的質量分數大
B.將t2℃時A、B的飽和溶液分別降溫至t1℃,此時兩溶液中的質量分數相等
C.在t2℃時,用兩份等量的水分別配制成A、B的飽和溶液,這兩種溶液的質量相等
D.在t2℃時,用等量的A、B分別配制成兩種飽和溶液,其質量分別mg和ng,則m
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】V2O3廣泛應用于治金、化工等行業,實驗室制取V2O3的流程如下:
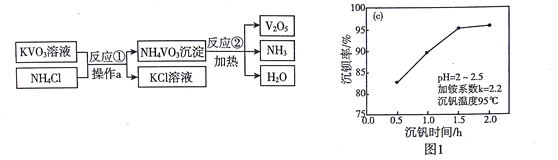
(1)KVO3中釩元素的化合價是_________
(2)操作a的名稱是____________。圖1表示反應①的沉釩率隨時間變化的情況,為使生成沉淀的效率較高,反應①適合的時間是__________小時。
(3)反應②的化學方程式為____________,該反應的基本類型是________
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】鐵礦石是怎樣煉成鐵的呢?某活動小組在實驗室模擬了鐵礦石煉鐵化學原理,如圖所示。
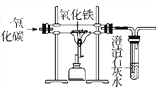
(1)該活動小組將實驗裝置組裝好后,設計了下列實驗操作步驟:①給玻璃管加熱;②停止加熱;③通入一氧化碳氣體;④停止通入一氧化碳氣體。
正確的操作步驟是____________(填序號);
(2)實驗過程中,玻璃管中固體由________色變成________色,玻璃管中反應的化學方程式是____________________________________,試管中出現的現象是______________;
(3)圖中有一處明顯錯誤,請說明改進方法______________________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】碳和碳的化合物是初中化學學習的重要內容。
﹙1﹚金剛石、石墨和C60都是由碳元素組成的單質,下列有關說法正確的是_____(填字母代號。)
A.都是黑色固體 B.硬度相同
C.完全燃燒都生成二氧化碳 D.碳原子的排列方式相同
﹙2﹚碳酸鈉廣泛用于玻璃、造紙、紡織和洗滌劑等的生產。
如何檢驗一瓶碳酸鈉溶液中是否混有氫氧化鈉?請簡要寫出實驗步驟和現象___________。
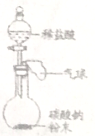
②下邊是某趣味實驗裝置圖,其氣密性良好。打開分液漏斗的活塞后,可觀察到氣球脹大的現象。請用化學方程式解釋產生此現象的原因 ___________。
﹙3﹚如下圖是實驗室中制取氣體常用到的儀器,請回答下列問題:
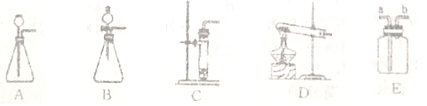
①請寫出用D裝置制取氧氣的化學方程式:________________。
②實驗室可用碳化鈣(CaC2)固體和水反應來制取乙炔(C2H2)氣體,該反應必須嚴格控制加水的速率,以免劇烈反應放熱引起發生裝置炸裂,則制取乙炔的最適合發生裝置是________;若用E裝置采用排水法來收集乙炔,乙炔氣體從_____進(填“a”或“b”)。
(4)乙炔(C2H2)是一種重要的化工原料。常用碳化鈣(CaC2)與水反應制取乙炔,同時生成氫氧化鈣。若要制取5.2g乙炔氣體,理論上需要碳化鈣的質量是____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com