
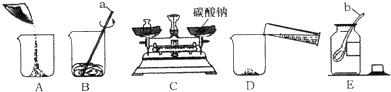
分析 (1)根據常見的化學儀器的名稱進行分析解答.
(2)根據配制溶質質量分數一定的溶液的基本步驟進行分析解答即可.
(3)利用溶質質量=溶液質量×溶質的質量分數,可根據溶液的質量和溶質的質量分數計算配制溶液所需要的溶質的質量;再根據溶劑質量=溶液質量-溶質質量即可求得水的質量.
(4)根據天平的使用方法是左物右碼,左盤的質量等于右盤的質量加游碼的質量,即藥品質量=砝碼質量+游碼質量,如果位置放反,根據左盤的質量=右盤的質量+游碼的質量,列等式進行計算.
(5)溶質質量分數變小,則可能是溶質質量偏小或溶劑質量偏大,可以分析出可能造成這兩個方面錯誤的原因進行分析解答;
(6)不能用水濕潤pH試紙,否則稀釋了待測溶液,使碳酸鈉溶液的堿性減弱,據此進行分析解答.
(7)根據pH試紙測定未知溶液的pH的方法進行分析解答.
解答 解:(1)儀器a是玻璃棒;儀器b是藥匙.
(2)配制一定溶質質量分數的碳酸鈉溶液,首先計算配制溶液所需碳酸鈉和水的質量,再稱量所需的碳酸鈉和量取水,最后進行溶解,以上實驗的正確操作順序為ECADB.
(3)溶質質量=溶液質量×溶質的質量分數,配制100g10%的該溶液,需碳酸鈉的質量=100g×10%=10g;溶劑質量=溶液質量-溶質質量,則所需水的質量=100g-10g=90g(合90mL);選取量筒時,盡量選用能一次量取的最小規格的量筒.量取90mL水時,應選擇100mL的量筒.
(4)圖中砝碼和藥品的位置放反了;由左盤的質量=右盤的質量+游碼的質量可知:砝碼質量=藥品質量+游碼的質量,所以藥品質量=砝碼質量-游碼質量,即實際稱得碳酸鈉的質量=10g-3.5g=6.5g.
溶質質量偏小,會造成碳酸鈉的質量分數偏小,則此時的碳酸鈉的質量分數小于10%.
(5)碳酸鈉中有雜質,會導致稱量的碳酸鈉的質量偏小,則使溶質質量分數偏小;用量筒量取水時,仰視液面,讀數比實際液體體積小,會造成實際量取的水的體積偏大,則使溶質質量分數偏小等.
(6)碳酸鈉溶液顯堿性,當溶液的pH大于7時,呈堿性,且pH越大,堿性越強;不能用水濕潤pH試紙,否則稀釋了待測溶液,使碳酸鈉溶液的堿性減弱,測定結果偏小.
(7)用pH試紙測定碳酸鈉溶液的pH時,正確的操作方法為用玻璃棒蘸取少量碳酸鈉溶液滴在干燥的pH試紙上,與標準比色卡對比來確定pH.
故答案為:
(1)玻璃棒;藥匙;(2)ECADB;(3)10;90;100mL;(4)6.5;小于;(5)碳酸鈉中有雜質或用量筒量取水時,仰視液面;(6)偏小;(7)用玻璃棒蘸取少量碳酸鈉溶液滴在干燥的pH試紙上,與標準比色卡對比來確定pH.
點評 本題難度不大,明確配制一定溶質質量分數的溶液實驗步驟、注意事項、pH試紙的使用方法等是正確解答本題的關鍵.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 75% | B. | 50% | C. | 67% | D. | 33.3% |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | NaNO3、NaCl、KNO3、(NH4)2SO4 | B. | H2SO4、HCl、AgNO3、Na2SO4 | ||
| C. | KMnO4、CuCl2、Fe2(SO4)3、NaNO3 | D. | K2SO4、NaCl、K2CO3、NaOH |
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題

查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
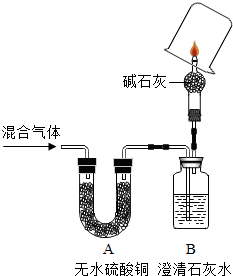 某混合氣體可能是CO、CO2、H2、H2O中的一種或幾種組成,為了驗證混合氣體的成分,設計了如圖的裝置進行實驗(堿石灰可吸收水蒸汽和二氧化碳,且每一步氣體均完全吸收),現象為:A中無明顯現象,B中澄清石水變渾濁,罩在火焰上方的小燒杯內壁中有水霧,迅速取下燒杯,向其中倒入澄清石灰水,澄清石灰水變渾濁.則原混合氣體的成分是( )
某混合氣體可能是CO、CO2、H2、H2O中的一種或幾種組成,為了驗證混合氣體的成分,設計了如圖的裝置進行實驗(堿石灰可吸收水蒸汽和二氧化碳,且每一步氣體均完全吸收),現象為:A中無明顯現象,B中澄清石水變渾濁,罩在火焰上方的小燒杯內壁中有水霧,迅速取下燒杯,向其中倒入澄清石灰水,澄清石灰水變渾濁.則原混合氣體的成分是( )| A. | CO、CO2 | B. | CO、CO2、H2 | C. | CO2、H2 | D. | CO、CO2、H2O |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
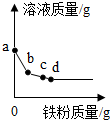 向一定量Cu(NO3)2、AgNO3的混合溶液中逐滴加入鐵粉,溶液質量與加入鐵粉的質量關系如圖所示:
向一定量Cu(NO3)2、AgNO3的混合溶液中逐滴加入鐵粉,溶液質量與加入鐵粉的質量關系如圖所示:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com