
為了測定某種石灰石中碳酸鈣的質量分數,取5 g石灰石樣品放入燒杯中,將60 g稀鹽酸分成四次加入燒杯中,充分反應后,測得實驗數據如下表(樣品中的雜質不與鹽酸反應也不溶于水)
請你分析并進行有關計算:
(1)哪幾次反應后,鹽酸有剩余___________________________________________。
(2)石灰石樣品中碳酸鈣的質量分數。
(3)上述實驗結束后,向燒杯內的物質中加入石灰石至不再產生氣泡,過濾。求濾液中溶質的質量分數。(結果精確到0.1%)
(1)三、四(1分)
(2)解:設5 g石灰石中CaCO3的質量為x。
CaCO3+2HCl===CaCl2+H2O+CO2↑(1分)
100 44
x 1.76 g(1分)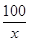 =
=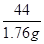 x=4 g(1分)
x=4 g(1分)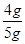 ×100%=80%(1分)
×100%=80%(1分)
(3)設60 g鹽酸完全反應需CaCO3質量為y,生成的CaCl2質量為z,共產生CO2質量為m。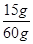 =
=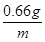 m=2.64 g(或0.66×4=2.64 g)(1分)
m=2.64 g(或0.66×4=2.64 g)(1分)
(或計算出第一次參加反應的CaCO3質量是1.5 g。1.5 g×4=6 g或通過第一次反應計算出鹽酸中溶質質量分數為7.3%也給1分)
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 111 44
y z 2.64 g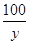 =
=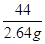 y=6 g(1分)
y=6 g(1分)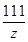 =
=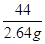 z=6.66 g(1分)
z=6.66 g(1分)
濾液質量:6 g+60 g-2.64 g=63.36 g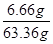 ×100%≈10.5%(1分)
×100%≈10.5%(1分)
答:(略)
(其他做法合理均得分)
解析


科目:初中化學 來源: 題型:
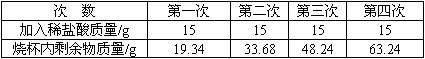
| 次 數 | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀鹽酸質量/g | 15 | 15 | 15 | 15 |
| 燒杯內剩余物質量/g | 19.34 | 33.68 | 48.24 | 63.24 |
查看答案和解析>>
科目:初中化學 來源: 題型:
為了測定某種石灰石中碳酸鈣的質量分數,取5 g石灰石樣品放入燒杯中,將60 g稀鹽酸分成四次加入燒杯中,充分反應后,測得實驗數據如下表(樣品中的雜質不與鹽酸反應也不溶于水)
請你分析并進行有關計算:
(1)哪幾次反應后,鹽酸有剩余___________________________________________。
(2)石灰石樣品中碳酸鈣的質量分數。
(3)上述實驗結束后,向燒杯內的物質中加入石灰石至不再產生氣泡,過濾。求濾液中溶質的質量分數。(結果精確到0.1%)
查看答案和解析>>
科目:初中化學 來源:包頭 題型:問答題
| 次 數 | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀鹽酸質量/g | 15 | 15 | 15 | 15 |
| 燒杯內剩余物質量/g | 19.34 | 33.68 | 48.24 | 63.24 |
查看答案和解析>>
科目:初中化學 來源:內蒙古自治區中考真題 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com