
 黃銅是一種重要的金屬,它是銅和鋅的合金,可用來制造機器、電器零件及日常用品.為了測定黃銅樣品的組成,取五份樣品分別加稀硫酸反應,其實驗數據記錄如下:
黃銅是一種重要的金屬,它是銅和鋅的合金,可用來制造機器、電器零件及日常用品.為了測定黃銅樣品的組成,取五份樣品分別加稀硫酸反應,其實驗數據記錄如下:| 樣品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
| 取樣品質量(g) | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
| 取稀硫酸質量(g) | 30.0 | 60.0 | 90.0 | 120.0 | 150.0 |
| 產生氣體質量(g) | 0.3 | 0.6 | 0.9 | 1.0 | 1.0 |
分析 (1)第4份加入120g硫酸生成氫氣1.0g,第5份中又多加了30g硫酸,但是生成氫氣的質量沒變,說明鋅已經被反應完了;
(2)根據生成氫氣的質量計算出鋅的質量,再用鋅的質量除以樣品的質量乘以百分之百即可;
(3)計算出40.0g樣品和稀硫酸恰好完全反應消耗的稀硫酸的質量.
解答 解:(1)第4份加入120g硫酸生成氫氣1.0g,第5份中又多加了30g硫酸,但是生成氫氣的質量沒變,說明鋅已經被反應完了,所以從第4份開始,金屬已經反應完了;
(2)解:設40g樣品中含鋅的質量為x,生成1.0g氫氣消耗的H2SO4的質量為y,
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 1.0g
$\frac{65}{x}=\frac{2}{1.0g}$
x=32.5g,
$\frac{98}{y}=\frac{2}{1.0g}$
y=49g
所以黃銅樣品中鋅的質量分數為:$\frac{32.5g}{40g}$×100%=81.25%
答:黃銅樣品中鋅的質量分數為81.25%
設稀硫酸的質量分數為w,由第一份樣品可知30.0g稀硫酸產生0.3g氫氣,
Zn+H2SO4=ZnSO4+H2↑
98 2
30×w 0.3g
$\frac{98}{30g×w}=\frac{2}{0.3g}$
w=49%
則40.0g樣品消耗的稀硫酸的質量=$\frac{49g}{49%}$=100g,則40.0g樣品中加稀硫酸的質量與產生氣體質量的關系曲線如圖所示: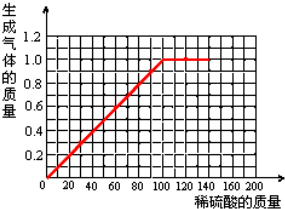
答案:
(1)4;
(2)該黃銅樣品中金屬鋅的質量分數為81.25%;
(3)稀硫酸的溶質質量分數為49%;
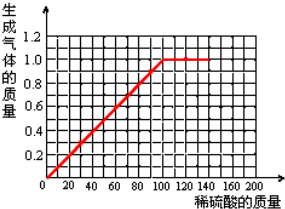
(4)
點評 解答本題關鍵是要通過圖表中數據分析出最多生成氫氣1.0g,再利用方程式計算出鋅的質量,再進一步進行計算.


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 有一瓶因保存不當而部分變質的氫氧化鈉固體,現在需要測定其組成,以探究其變質程度.為了測定其組成成分,某研究小組稱取了5.32g的NaOH樣品(雜質為Na2CO3),然后配制成溶液并向溶液中逐滴加入稀鹽酸,根據生成CO2的質量來測定其中Na2CO3的質量,并進一步確定樣品中NaOH的變質程度.已知實驗測得加入稀鹽酸的質量與產生CO2氣體的質量關系如下圖所示.試求:
有一瓶因保存不當而部分變質的氫氧化鈉固體,現在需要測定其組成,以探究其變質程度.為了測定其組成成分,某研究小組稱取了5.32g的NaOH樣品(雜質為Na2CO3),然后配制成溶液并向溶液中逐滴加入稀鹽酸,根據生成CO2的質量來測定其中Na2CO3的質量,并進一步確定樣品中NaOH的變質程度.已知實驗測得加入稀鹽酸的質量與產生CO2氣體的質量關系如下圖所示.試求:查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 用水沖洗泄漏的濃硫酸 | B. | 將熟石灰撒在泄漏出的濃硫酸上 | ||
| C. | 將氯化鋇撒在泄漏出的濃硫酸上 | D. | 用土將泄漏出的濃硫酸掩埋 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 分子是保持物質性質的最小粒子 | B. | 分子的質量一定比原子的質量大 | ||
| C. | 分子一定由原子構成 | D. | 物質一定由分子構成 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com