
| 離子 | Na+ | Mg2+ | Cl- | SO42- |
| 濃度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
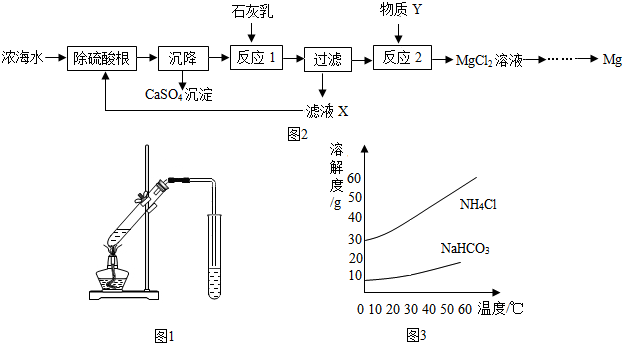
分析 (1)根據粗鹽中的雜質,找出所加試劑的順序;
(2)海水淡化的方法主要有:蒸餾法、結晶法、淡化膜法、多級閃急蒸餾法,可根據原理進行分析;
(3)該反應是氫氧化鈣與氯化鎂的反應;
該過程主要是分離氫氧化鎂沉淀和溶液;
根據題干信息進行分析;
(4)可根據物質的溶解度分析.
解答 解:(1)要除去粗鹽中含有的雜質,可以加過量的氫氧化鋇溶液除去硫酸鎂,加過量的Na2CO3溶液除去氯化鈣和過量試劑氫氧化鋇,通過過濾把不溶于水的物質除去,加適量的鹽酸除去過量的碳酸鈉,通過蒸發除去鹽酸;
故填:acdbe;除去氯化鈣和過量試劑氫氧化鋇;
(2)蒸餾水是純凈物,蒸干后不留任何痕跡,即蒸干后沒有晶體析出;
故答案:蒸干后沒有晶體析出;
(3)反應1是氫氧化鈣與氯化鎂發生復分解反應生成氯化鈣和氫氧化鎂白色沉淀;故填:Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓;
將物質過濾分離后所得溶液主要是氯化鈣和氯化鈉的溶液,故填:CaCl2、NaCl;
化學反應前后元素的質量不變,因為1L濃海水中含有28.8g鎂元素,那么2L濃海水中含有2×28.8g=57.6g鎂元素.故填:57.6;
(4))氨堿法制純堿中生成NaHCO3和NH4Cl的反應方程式為:NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl;
反應中生成NaHCO3和NH4Cl的質量比為84:53.5,比NH4Cl多且溶解度比NH4Cl小,因此先達到飽和,
故答案:生成的NaHCO3質量比NH4Cl多且溶解度比NH4Cl小,先達到飽和;
(1)acdbe;除去氯化鈣和過量試劑氫氧化鋇;
(2)蒸干后沒有晶體析出;
(3)Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓; CaCl2、NaCl;57.6;
(4)NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl;生成的NaHCO3質量比NH4Cl多而溶解度比NH4Cl小,先達到飽和.
點評 本題難度比較大,涉及海水淡化方法的原理、海水曬鹽的原理、除雜的原理、侯氏制堿法的原理等理論內容,要通過該題認真總結.


科目:初中化學 來源: 題型:實驗探究題
| 實驗步驟 | 實驗現象 | 結論 |
| 1.取少許該溶液于試管中,滴入適量的溶液. | 猜想二正確 | |
| 2.靜置上述溶液,取上層清液少許于另一支試管中,滴入幾滴溶液 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 對污染水體作處理使之符合排放標準 | |
| B. | 應用新技術、新工藝減少污染物的產生 | |
| C. | 加大汽車尾氣檢測力度,減少空氣污染 | |
| D. | 減少使用農家肥,大量使用化肥和農藥 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
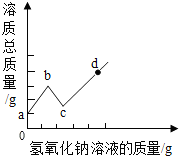 將某氫氧化鈉溶液逐滴滴入硫酸和硫酸銅的混合溶液中,直至過量:根據實驗事實繪制如圖所示曲線,請回答:
將某氫氧化鈉溶液逐滴滴入硫酸和硫酸銅的混合溶液中,直至過量:根據實驗事實繪制如圖所示曲線,請回答:查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
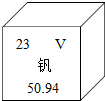 釩被譽為“合金的維生素”,釩元素的相關信息如圖所示.下列有關釩的說法不正確的是( )
釩被譽為“合金的維生素”,釩元素的相關信息如圖所示.下列有關釩的說法不正確的是( )| A. | 屬于金屬元素 | B. | 原子序數為23 | ||
| C. | 原子核外電子數為23 | D. | 相對原子質量為50.94g |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
 已知A~F六種物質均為初中化學常見物質,其中B、E為氧化物,A、B、D、F為不同類別的化合物,A、B、D分別放入水中都能使酚酞溶液變紅,如圖是它們之間的關系(部分反應物和產物已省略;“→”表示轉化,“-”表示相互反應).
已知A~F六種物質均為初中化學常見物質,其中B、E為氧化物,A、B、D、F為不同類別的化合物,A、B、D分別放入水中都能使酚酞溶液變紅,如圖是它們之間的關系(部分反應物和產物已省略;“→”表示轉化,“-”表示相互反應).查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
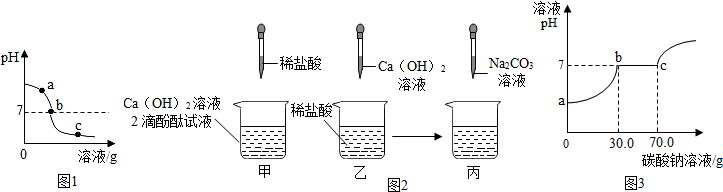
| 實驗步驟 | 實驗現象 | 實驗結論 |
| 另取余下樣品少量于兩支試管中,分別滴加足量的Na2CO3溶液. | ①只產生白色沉淀 | 該樣品為b處溶液. |
| ②先產生氣泡,后產生白色沉淀 | 該樣品為c處溶液,并推知溶液中的陽離子有Ca2+、H+ |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com