氧化亞銅(Cu2O)可用于生產船底防污漆,防止海生物對船舶設備的污損.現將Cu2O和Cu的固體混合物6.8g放入燒杯中,加入過量的質量分數為20%的稀硫酸30g,充分反應后,過濾、洗滌、干燥,得到4.8g固體.
已知:Cu2O+H2SO4=CuSO4+Cu+H2O
計算:(1)所加稀硫酸中溶質的質量為______g.
(2)原混合物中Cu2O與Cu的質量比(寫出過程,結果用最簡整數比表示).
解:(1)所加稀硫酸中溶質的質量=20%×30g=6g;故填:6;
(2)設原混合物中含Cu
2O的質量為x
Cu
2O+H
2SO
4=Cu+CuSO
4+H
2O 固體質量減少
144 64 144-64=80
x 6.8g-4.8g=2g
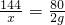
x=3.6g
原混合物中Cu的質量=6.8g-3.6g=3.2g
原混合物中Cu
2O與Cu的質量比=3.6:3.2=9:8
答:原混合物中Cu
2O與Cu的質量比9:8.
分析:(1)根據質量分數的含義進行解答;
(2)將6.8gCu和Cu
2O的混合物放入足量的稀硫酸中,銅不參加反應,反應后固體的質量減少是因Cu
2O→Cu引起的,宜用差量法解答.
點評:差量法就是根據化學方程式,利用反應物和生成物之間的質量差與反應中反應物、生成物的量成比例的關系進行計算的一種捷徑.該方法的關鍵是分析反應前后形成差量的原因,找出差量與某些量之間的比例關系,然后再由比例式求解.



 新課標階梯閱讀訓練系列答案
新課標階梯閱讀訓練系列答案