
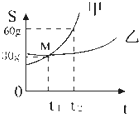
 如圖是甲.乙兩種固體物質的溶解度曲線,試回答下列問題:
如圖是甲.乙兩種固體物質的溶解度曲線,試回答下列問題:分析 (1)根據物質的溶解度曲線可以判斷某一溫度時物質的溶解度大小比較;
(2)溶解度曲線在上方的物質溶解度大于曲線處在下方的物質;
(3)將飽和溶液變成不飽和溶液,通行的方法是加水稀釋;另外還可以改變溫度來實現,溶解度隨溫度升高而增大的物質,升溫使飽和溶液變成不飽和溶液,反之相反;
(4)結晶提純物質的方法分兩種:蒸發結晶或冷卻結晶.物質的溶解度受溫度變化影響不大時通常采取蒸發結晶的方法,物質的溶解度受溫變化度影響較大時通常采取冷卻結晶的方法.
(5)根據t2℃時.甲的溶解度解答;
(6)根據t1℃時甲和乙的飽和溶液中溶質的質量分數相等,將t1℃時甲和乙的飽和溶液同時升高t2℃,甲和乙的溶質和溶劑質量不變,因此所得溶液中溶質的質量分數的大小關系是甲=乙.
(7)據t2℃時兩物質的溶解度及飽和溶液中溶質的質量分數分析解答;
(8)根據物質的溶解度曲線、飽和溶液的質量可以判斷降低溫度時析出晶體的質量關系;
(9)根據甲乙的溶解度分析解答.
解答 解:
(1)曲線中M點表示:在t1℃時,甲、乙的溶解度相等;故答案為:t1℃時,甲和乙兩種物質的溶解度相等;
(2)t2℃時,甲物質的曲線在乙物質曲線的上方,表明此時甲物質溶解度大于乙物質.若是S甲<S乙,對應的溫度范圍是0<t<t1;
(3)甲物質的溶解度隨溫度升高而增大,所以采取升溫的方法即可將甲物質的飽和溶液變為不飽和溶液.
(4)曲線圖顯示,甲物質溶解度愛溫度影響較大,若要從甲飽和溶液中獲得甲的晶體,通常采取的方法冷卻熱飽和溶液的方法;
乙物質的溶解度受溫度影響不大,若要從乙的飽和溶液中獲取乙,通常采用的方法是蒸發結晶的方法;
(5)t2℃時.甲的溶解度是60g,因此30g甲物質加入到50g水中不斷攪拌形成溶液質量是=30g+50g=80g;
(6)t1℃時甲和乙的飽和溶液中溶質的質量分數相等,將t1℃時甲和乙的飽和溶液同時升高t2℃,甲和乙的溶質和溶劑質量不變,因此所得溶液中溶質的質量分數的大小關系是甲=乙;
(7)t2℃時,甲的溶解度大于乙的溶解度,向兩只盛有100g水的燒杯中,分別加入甲、乙兩種物質至不能溶解為止,說明形成的是該溫度下的飽和溶液,故所得溶液的溶質質量分數較大的是甲;
(8)t2℃時,甲的溶解度大于乙的溶解度,t1℃時,A的溶解度等于B的溶解度,因此將t2℃時兩種物質的飽和溶液各200g降溫到t1℃時析出晶體的質量大小關系是甲>乙;
(9)在t1℃時,兩物質的溶解度相等,而在t2℃時甲的溶解度大于乙的溶解度,因此將t1℃時兩種物質的飽和溶液各200g升溫到t2℃時欲使它們仍為飽和溶液,若不改變溶劑質量所需加入固體溶質質量關系是所加溶質的質量甲比乙多.
故答:甲大于乙;
答案:
(1)t1℃時,甲和乙兩種物質的溶解度相等;
(2)甲>乙;0<t<t1;
(3)升溫(或增加溶劑);
(4)冷卻熱飽和溶液;蒸發結晶;
(5)80g;
(6)甲=乙;
(7)甲;
(8)甲>乙;
(9)甲>乙
點評 溶解度曲線能定量地表示出溶解度變化的規律,從溶解度曲線可以看出:同一溶質在不同溫度下的溶解度不同;同一溫度下,不同溶質的溶解度可能相同,也可能不同;溫度對不同物質的溶解度影響不同.


 名校課堂系列答案
名校課堂系列答案科目:初中化學 來源: 題型:選擇題
| A. | 通常把pH<7的降水稱為酸雨 | |
| B. | 原子的質量幾乎都集中在原子核中 | |
| C. | 氯化銨可以與草木灰(含碳酸鉀)混合施用 | |
| D. | 生活中常接觸到的“高鈣牛奶”、“碘鹽”中的“鈣”、“碘”指的是離子 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 油庫著火用水撲滅 | |
| B. | 炒菜時油鍋著火,立即蓋上鍋蓋 | |
| C. | 進入久未開啟的菜窖前,用燃著的蠟燭做“燈火試驗” | |
| D. | 廚房煤氣管道泄氣,立即關閉閥門并開窗通風 |
查看答案和解析>>
科目:初中化學 來源: 題型:選擇題
| A. | 碳和四氧化三鐵 | B. | 木炭粉 | C. | 碳粉和氧化銅 | D. | 二氧化錳 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com