某工廠每天產生濃度為0.49%的廢H2SO4溶液1×106g,需要用堿溶液中和處理.試計算:
(1)該廠每天要處理的廢酸液中含有H2SO4______g,是______mol H2SO4.
(2)若用燒堿處理廢酸液,每天需要NaOH______mol.
(3)若改用熟石灰處理廢酸液,則每天需要Ca(OH)2的物質的量______NaOH的物質的量(填“大于”、“小于”或“等于”).
解:(1)每天要處理的廢酸液中含有H
2SO
4的質量=1×10
6g×0.49%=4900g;
每天的處理廢水中H
2SO
4的物質的量=
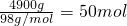
;
故答案為:4900;50;
(2)根據反應的化學方程式2NaOH+H
2SO
4=Na
2SO
4+2H
2O,可知NaOH與H
2SO
4反應的物質的量之比為2:1,
則需要NaOH物質的量=2×50mol=100mol;
故答案為:100;
(3)根據Ca(OH)
2+H
2SO
4=CaSO
4+2H
2O,可知Ca(OH)
2與H
2SO
4反應的物質的量之比為1:1,小于NaOH與H
2SO
4反應的物質的量之比(2:1),則每天需要Ca(OH)
2的物質的量小于NaOH的物質的量.
故答案為:小于.
分析:(1)利用溶質質量=溶液質量×溶液的溶質質量分數,計算每天要處理的廢酸中硫酸的質量;再使用n=

求得硫酸的物質的量;
(2)根據反應的化學方程式,判斷氫氧化鈉與硫酸反應時兩物質的物質的量的比,然后根據硫酸的物質的量計算需要氫氧化鈉的物質的量;
(3)根據反應的化學方程式,判斷使用氫氧化鈣時氫氧化鈣與硫酸的物質的量的比,與使用氫氧化鈉反應時進行對比,判斷每天需要兩種堿物質的量的大小關系.
點評:利用反應的化學方程式可以表示反應中各物質的量的關系,可根據一種物質的量而求得反應中其它物質的量.

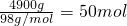 ;
; 求得硫酸的物質的量;
求得硫酸的物質的量;
